한국노바티스, 킴리아 급여 3주년 기념 인포그래픽 배포
국내 킴리아 치료 접근성 강화 위한 노력 및 임상적 가치 수록
- 노영희 기자 nyh2152@medifonews.com
- 등록 2025-04-16 10:34:51
한국노바티스㈜(대표이사 사장 유병재)는 자사의 CAR-T 치료제 ‘킴리아(성분명 티사젠렉류셀)’의 건강보험 급여 적용 3주년을 맞이해, 임상연구 및 실제 진료 현장에서 확인된 킴리아의 임상적 가치와 더 나은 치료 환경 제공을 위한 킴리아의 노력을 담은 인포그래픽을 배포했다고 16일 밝혔다.
이번 인포그래픽은 킴리아의 건강보험 급여 적용 3주년을 모멘텀으로 ▲환자 치료 접근성 개선을 위한 꾸준한 변화 및 성과 ▲임상시험 및 실제 진료 현장에서 확인된 킴리아의 치료 효과 및 안전성 프로파일 ▲킴리아의 처방 신뢰 강화를 위한 지속적인 노력을 주요 골자로 했다.
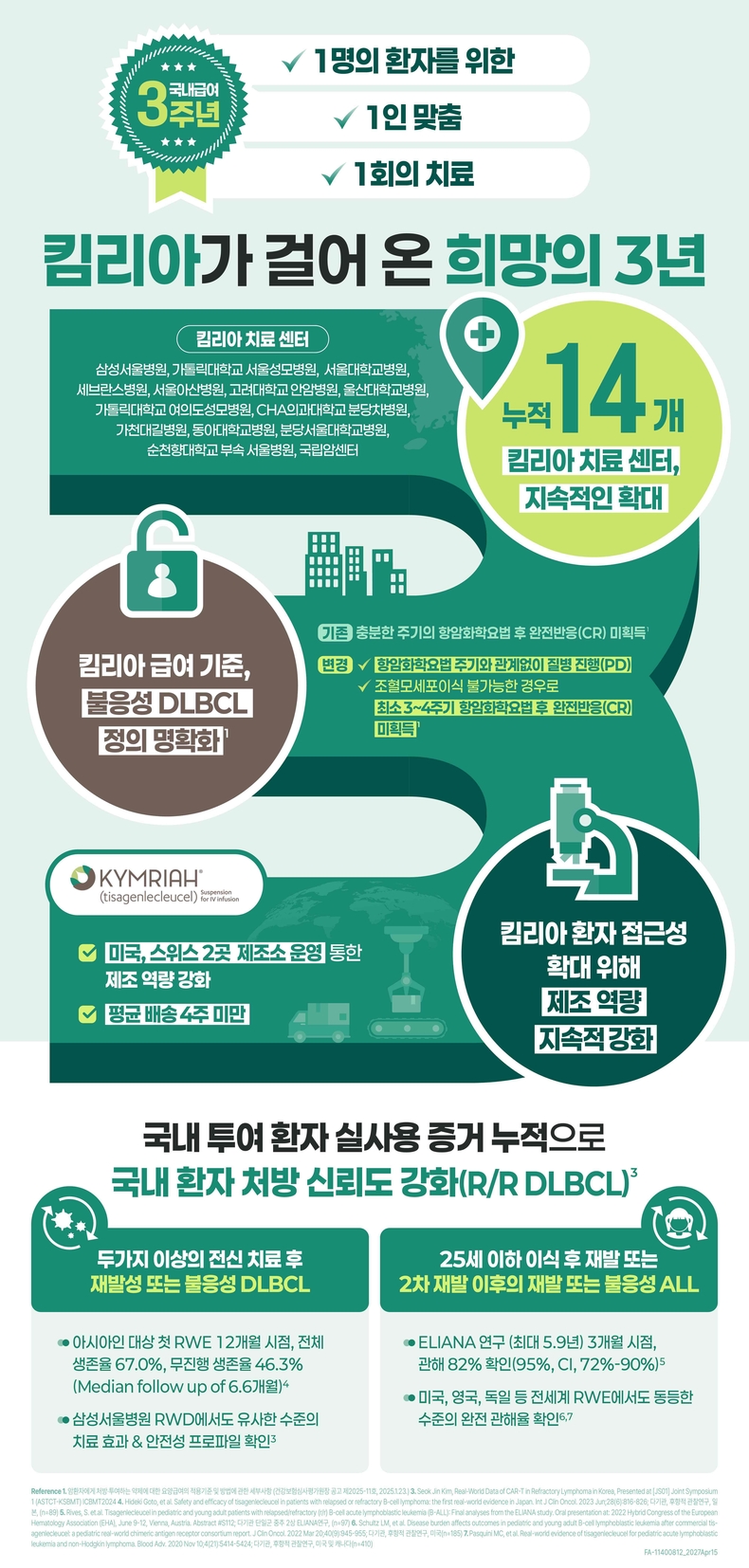
▲치료 센터 확대∙급여조건 명확화∙단축된 제조기간…킴리아 치료 접근성 한층 강화
킴리아는 제조 및 치료 과정에서 고도의 전문화된 인력과 인프라가 수반돼야 한다. 이에 한국노바티스는 국내 CAR-T 치료 접근성 개선 및 환자 치료 기회 확대를 위해 CAR-T 치료 센터 신설에도 노력을 기울이고 있다. 최근에는 5곳(가천대길병원, 동아대학교병원, 분당서울대학교병원, 순천향대학교부속서울병원, 국립암센터)의 CAR-T 치료 센터가 신설됨에 따라 총 14곳(삼성서울병원, 가톨릭대학교서울성모병원, 서울대학교병원, 세브란스병원, 서울아산병원, 고려대학교안암병원, 울산대학교병원, 가톨릭대학교여의도성모병원, CHA의과대학교분당차병원)에서 치료가 가능해졌다.
더불어 지난 2월, 킴리아의 재발성 또는 불응성 미만성거대B세포림프종(Relapsed/Refractory Diffuse Large B Cell Lymphoma, 이하 r/r DLBCL) 적응증에 대한 급여조건 중 ‘불응성’을 지칭하는 정의가 명확화 돼 보다 최적화된 CAR-T 치료 전략 수립이 가능해질 것으로 보인다. 이에 따라 킴리아 투여를 고려하는 환자들은 적절한 시기에 치료 여부를 결정할 수 있게 됐다.
기존에는 ‘충분한 주기의 항암화학요법 후 반응 평가에서 완전반응(Complete Response, 이하 CR)을 얻지 못한 경우’로 불응성의 의미를 정의했으나, 변경된 기준에서는 ‘항암화학요법 주기와 관계없이 질병 진행(Progressive Disease, PD)이거나 조혈모세포이식이 불가능한 경우, 최소 3-4주기의 항암화학요법을 받은 후에도 CR을 얻지 못한 경우’로 급여기준을 더욱 명확하게 명시하고 있다.
킴리아는 치료 접근성 확대를 위해 제조 역량을 지속적으로 강화하고 있으며, 제품의 제조 및 배송 기간도 4주 미만으로 단축해 더 많은 환자들이 신속하게 치료받을 수 있도록 앞장서고 있다.
▲실제 진료 현장의 다양한 환자군에서도 지속적으로 의학적 근거 마련하는 킴리아
2024 대한조혈모세포이식학회(International Congress of Blood and Marrow Transplantation, ICBMT)에서 삼성서울병원이 발표한 국내 r/r DLBCL에서 CAR-T 치료 성과를 분석한 실사용데이터(Real World Data, RWD)에 따르면, 킴리아의 효과 및 안전성은 JULIET 임상 연구와 유사한 수준으로 확인됐다. 연구에 따르면, 킴리아는 한국인 환자를 대상으로도 글로벌 임상연구와 유사한 수준의 치료 반응과 생존율을 보였다.
뿐만 아니라, 킴리아는 미국, 영국, 독일 등 전 세계 RWE에서도 임상연구와 유사한 수준의 치료 효과 및 안전성 프로파일을 입증했다. 2023년 미국혈액학회(ASH)에서 발표된 r/r DLBCL 환자(n=1375)을 대상으로 한 실제 임상 연구 데이터에 따르면, 킴리아는 특히 75세 이상 고령의 환자에서도 75세 미만의 환자들과 유사한 수준의 임상적 유용성과 안전성 프로파일을 보였다.
또 일본의 진료 환경에서 킴리아의 치료 성적을 평가한 RWE 데이터(n=89)에서, 추적 관찰 중앙값인 6.6개월 동안 73.0%의 환자가 임상적 반응을 보였으며, 12개월차 전체 생존율은 67%, 무사건생존율(Event-Free Survival, EFS)은 46.3%로 허가 임상연구보다 더 높은 전체 생존율, 무사건생존율을 확인했다.
한국노바티스 혈액암사업부 이지윤 전무는 “킴리아는 단 한명의 환자를 위한 맞춤형 치료제로, 새로운 기전을 바탕으로 임상연구와 실사용데이터에서 장기간 치료 효과와 안전성을 지속적으로 확인해 가며 r/r DLBCL, r/r ALL, r/r FL 환자에서 혁신적인 치료 옵션으로 자리매김했다”며 “앞으로도 한국노바티스는 국내 혈액암 분야 CAR-T 치료의 리딩 기업으로서 더 많은 국내 환자가 킴리아의 임상적 혜택을 누릴 수 있도록 폭넓은 의학적 근거를 마련하고 치료 센터 확장과 제조 기간 단축 등을 통해 환자 치료 기회 확대를 위한 접근성 강화에 노력을 거듭할 것”이라고 말했다.
한편, r/r DLBCL 및 r/r ALL 환자들에게 혁신적인 1인 맞춤형 CAR-T 치료를 제공하는 킴리아는 지난 2021년 3월 제 1호 첨단바이오의약품으로 국내 허가를 받은 데 이어 이듬해 2022년 4월 r/r DLBCL, r/r ALL 적응증에서 건강보험 급여가 적용됐다. 이후 2023년에는 r/r FL 성인 환자의 치료로 추가적인 적응증을 확대한 바 있다.
이로써 킴리아는 기대여명 6개월의 말기 혈액암 치료에서 단 한 번의 투여로 장기 치료 효과와 장기 생존 가능성을 제시한 데 이어 비교적 치료 예후가 좋지만 재발이 잦고 반복된 재발로 공격적인 질환 특성과 불량한 치료 예후를 보이는 소포성림프종 치료에서도 임상적 유용성을 확인해 혈액암 분야에서 그 역할 및 가치가 더욱 확대될 것으로 보인다.
관련기사
- 노바티스, 중국 RWD 기반 PNH 치료과제와 파발타 임상근거 조명 2026-01-19
- 제6회 헬스엑스 챌린지 서울, 메라키플레이스·그린리본 선정 2025-12-23
- 노바티스, 코센틱스 급여 확대 기념 ‘HOPE’ 심포지엄 성료 2025-12-22
- 유방암 환자, 年 1400억원 이상의 사회경제적 부담 초래 2025-12-18
- 노바티스, 미국혈액학회서 파발타 장기 데이터 및 신규 환자군 분석 공개 2025-12-17
- 노바티스, 미국학회서 셈블릭스 CML 1차 치료 내약성 및 이상반응 최신 데이터 발표 2025-12-16
- 노바티스 ‘코센틱스’, 성인 중증 화농성 한선염 환자에 급여 적용 2025-11-28
- 노바티스 ‘파발타’, 희귀신장질환 C3G치료에 적응증 확대 2025-11-19
- 코센틱스, 화농성 한선염에서 4년장기 유효성 및 안전성 확인 2025-11-07
- 키스칼리, ESMO 2025서 조기 유방암 환자 5년 장기 추적 데이터 발표 2025-10-22
- “치료제 존재하는 희귀·난치성 질환 정부지원 검사 도입돼야” 2025-10-14
- 노바티스, 만성두드러기 환자들과 함께 ‘만두의 꿈’ 캠페인 전개 2025-10-13
- 노바티스, CML 환자 일상회복 응원 캠페인 ‘아주 보통의 하루’ 전개 2025-09-29
- 노바티스, 블루엠텍과 렉비오 개원가 판매 프로모션 체결 2025-09-23
- 노바티스, 학술대회서 국내 4년간의 ‘킴리아’ 여정 담은 초록 발표 2025-09-15
- 노바티스, ‘마미톡 어바웃, 우리 아이 바른 성장’ 개최 (9/17) 2025-09-12
- 서울바이오허브-노바티스, ‘헬스엑스챌린지 서울 2025’ 참여기업 모집 (~9/26) 2025-09-08
- 노바티스, 국내 첫 경구용 PNH 치료제 파발타™ 론칭 심포지엄 성료 2025-08-26
- 노바티스 키스칼리, 재발 위험 높은 조기 유방암 보조요법에 허가 2025-08-25
- 노바티스 ‘셈블릭스’, ELN 가이드라인서 CML 환자 1차 치료제로 권고 2025-08-18
- 노바티스, 만성두드러기 캠페인 홍보대사 모집 2025-07-02
- 노바티스, 유럽혈액학회서 파발타™ 최신 임상 결과 발표 2025-07-01
- 노바티스, 유전성 망막질환 온라인 강좌 (7/8) 2025-06-27
- 노바티스, 유럽혈액학회서 셈블릭스 CML1차 치료 최신 데이터 발표 2025-06-25
- 조기 유방암 환자 1인당 평균 경제손실비용 최대 7507만원 2025-06-12
- 노바티스, 두드러기약 ‘졸레어’ 허가 18주년 기념 인포그래픽 공개 2025-05-30
- 노바티스, KCR 2025에서 ‘코센틱스’ 런천 심포지엄 성료 2025-05-27
- 노바티스, 직원 주도 ‘데이터 플로깅’ 봉사활동 나서 2025-04-10
- 노바티스, 유전성 재발열 증후군 알리는 캠페인 홈페이지 개설 2025-04-07
- 노바티스 코센틱스, 소아·청소년 중증 판상건선에 급여 적용 2025-04-01
- 노바티스, ‘Lp(a) 인식의 날’ 맞아 임직원 대상 캠페인 진행 2025-03-25
- 노바티스, 화농성 한선염 질환 인식 개선 웹드라마 ‘보통의 날’ 공개 2025-03-14
- 노바티스, ‘Super Nova’ 심포지엄서 코센틱스∙일라리스 가치 공유 2025-03-11
- 노바티스 ‘셈블릭스’, Ph+ 만성골수성백혈병 1차치료에 허가 2025-02-27
- 노바티스, 심혈관중재학회 학술대회서 ‘렉비오’ 심포지엄 성료 2025-01-21
- 코센틱스, 유럽 가이드라인서 중등도-중증 화농성한선염 1차치료 권고 2025-01-06
- 노바티스, 제5회 헬스엑스 챌린지 서울 공모 프로젝트 최종 선정기업 발표 2024-12-23
- 노바티스 셈블릭스, 실제 임상에서 표준치료 타당성 확인 2024-12-19
- 노바티스, 글로벌 2024 의약품 접근성 지수 1위 2024-12-09
- 노바티스, 피부과의료진 대상 화농성한선염 마스터클래스 심포지엄 성료 2024-12-03
- 가수 이홍기, 화농성한선염 캠페인으로 ‘올해의 홍보대사상’ 수상 2024-11-27
- 엔트레스토, PARADE-HF 연구 ESC 심부전 학술지 게재 2024-11-11
- 노바티스, 희귀·난치성질환 환우와 가족을 위한 희망 캠페인 진행 2024-10-21
- 노바티스, 유방암 인식증진 위한 ‘유비무환(乳備無患)’ 사내행사 성료 2024-10-18
- 노바티스, ‘라핀나’ 전이성흑색종 허가 10주년 기념 인포그래픽 공개 2024-10-15
- 노바티스, ‘7일 간의 두드러기 관찰일기’ 캠페인 전개 2024-09-30
- 노바티스, 세계 만성골수성백혈병의 날 기념 환자 응원하는 사내 행사 개최 2024-09-24
- 노바티스, ‘세계 골수증식종양 인식의 날’ 맞아 사내캠페인 진행 2024-09-11
- 노바티스, 서울시민 대상 콜레스테롤 인식개선 캠페인 진행 2024-09-06
- 노바티스, 발작성 야간 혈색소뇨증 국내 최초 단일 경구 치료제 파발타™ 허가 2024-08-29
- “일라리스, 유전성재발열증후군에서 완전반응 달성률 우수” 2024-08-09
- 한국노바티스 siRNA 치료제 ‘렉비오’ 보조요법으로 국내 허가 2024-06-20
- 노바티스, 임직원 심혈관 건강 증진 위한 ‘언블락드 챌린지’ 3회차 성료 2024-06-05
- 노바티스, 온라인 ‘스토리 워크샵’ 참여자 모집 (6/3~30) 2024-06-03
- 노바티스, 면역성혈소판감소증 약 ‘레볼레이드’ 비장절제술 없어도 급여 2024-06-03
- 엔트레스토, 유럽심장학회서 심부전 증상 개선 및 위험 감소 효과 재확인 2024-05-30
- 엔트레스토, ACC 연례학술대회서 심부전 입원율 감소‧질환 개선 재확인 2024-04-24
- 노바티스 킴리아 급여 2년, 환자 위한 치료 환경 개선 2024-04-23
- 코센틱스, 한국인 활동성 강직성척추염 환자 대상으로 효과‧안전성 확인 2024-04-11
- 노바티스, 암종불문 고형암 표적치료제 라핀나 매큐셀 인포그래픽 공개 2024-04-04
- ACC ECDP, C단계‧처음 진단받은 HFrEF 환자에 엔트레스토 등 우선사용 권고 2024-04-03
- 노바티스, 서울시 직장인 위한 ‘찾아가는 혈관건강 상담실’ 진행 2024-03-07
- 노바티스, 이홍기와 함께한 화농성 한선염 캠페인 유튜브 조회수 100만 돌파 2024-01-25
- 노바티스, 소아 류마티스 환우∙가족 응원하는 ‘동행’ 기부 캠페인 진행 2023-12-20
- 키스칼리, 3건의 3상서 고령환자 대상 일관된 OS∙PFS 연장 확인 2023-12-19
- 노바티스, 가수 이홍기와 함께 화농성 한선염 질환 인식 개선 위한 캠페인 영상 공개 2023-12-18
- 노바티스 ‘셈블릭스’, 장기적인 임상적 유효성·안전성 확인 2023-12-18
- 노바티스 ‘코센틱스’, 화농성한선염 치료 등에 적응증 확대 2023-12-15
- 킴리아, 미국혈액학회에서 최신 연구 데이터 3건 발표 2023-12-13
- 노바티스 ‘코센틱스’, 강직성척추염 1차 생물학적 제제로 급여 확대 2023-12-04
- 노바티스, 전립선암 인식 개선 위한 모벰버 캠페인 진행 2023-11-08
- 노바티스, 유전성 망막변성질환 유전자 검사 지원 프로그램 얼리버드 시즌2 시작 2023-11-06
- 노바티스 ‘자카비’, 이식편대숙주질환 치료에서 보험 급여 적용 2023-11-01
- 서울시-심혈관중재학회-노바티스, 이상지질혈증 예방관리체계 구축 위해 협약 2023-10-26
- 노바티스, 희귀난치성 환우∙가족과 ‘치유(CHEERYOU)’ 시즌 7 진행 2023-09-18
- 노바티스, ‘세계 골수증식종양 인식의 날’ 맞아 사내 캠페인 진행 2023-09-14
- 엔트레스토, 유럽심장학회 연례학술회의에서 신장 관련 연구결과 발표 2023-09-05
- 노바티스, 유전성 망막변성질환 의학적 견해 공유하는 ‘제나클 심포지엄’ 성료 2023-07-10
- ‘엔트레스토’, 좌심실 박출률 40% 이하 만성심부전 1차 치료에 급여 확대 2023-07-03
- 노바티스 ‘셈블릭스’, 만성골수성백혈병 3차 이상 치료에 급여 2023-06-30
- 노바티스 ‘코센틱스’, 전 세계적으로 100만 환자에 처방 2023-06-20
- “만성골수성백혈병 치료, 여전히 미충족 수요 존재” 2023-06-19
- 노바티스 플루빅토, 식약처 ‘글로벌 혁신제품 신속심사’ 대상약제 지정 받아 2023-06-13
- 엔트레스토, ESC 심부전 학술대회에서 국내 환자 RWD 분석결과 발표 2023-06-01
- 노바티스, IL-17A 억제제 ‘코센틱스우노레디펜 300mg/2mL’ 급여 적용 2023-05-30
- 노바티스, 유전성 망막변성질환 유전자 검사 지원 프로그램 ‘Early Bird’ 론칭 2023-05-23
- 노바티스 CAR-T 치료제 ‘킴리아’, 소포성림프종 적응증 확대 2023-04-05
- 노바티스, ‘졸겐스마TM’ 최대 7.5년 장기 효과 및 안전성 확인 2023-03-30
- 노바티스, SMA환우회∙백지영과 다시 뭉쳤다…응원의 노래 2023-02-28
- 키스칼리, NCCN서 CDK4/6 억제제 중 유일하게 ‘카테고리 1’ 권고 2023-02-14
- 노바티스 ‘키스칼리’, 유방암 환자 1차치료서 병용요법 대비 PFS 1년 연장 2022-12-26
- 노바티스, 제1회 ‘유전자 치료 포럼’서 최신지견 공유 2022-12-22
- ‘엔트레스토’, 한국인 대상 안정적 용량∙심장 구조 개선 재확인 2022-12-05
- 노바티스, IL-17A 억제제 ‘코센틱스우노레디펜 300mg/2mL‘ 허가 2022-11-08
- 노바티스, 희귀·난치성 환우·가족을 위한 ‘치유’ 시즌 6 개최 2022-10-24
- 노바티스, 세계 두드러기의 날 기념 만성두드러기 이심전심 인포그래픽 공개 2022-09-30
- 노바티스, 서울시·진흥원과 제3회 ‘헬스엑스 챌린지 서울’ 최종선정기업 발표 2022-09-30
- ‘키스칼리’, 예후 불량한 내장전이 유방암환자에 OS 연장 입증 2022-09-23
- 노바티스, SMA 유전자대체약 ‘졸겐스마’ 론칭 심포지엄 성료 2022-08-29
- 노바티스, 100% 기업분할 방식으로 산도스 분사 결정 2022-08-26
- [인사]질병관리청 승진 및 전보 (3/9)
- [인사]전남대병원, 화순병원장·치과병원장·화순군립요양병원장 임명
- [동정]휴젤, ‘2025년 코스닥시장 공시우수법인’ 선정
- [동정]고대 구로병원 안과 송종석 교수 연구팀, 아시아태평양안과학회 Best Scientific Paper Award 수상
- [동정]고려의대 융합의학교실 최낙원 교수, 한국공학한림원 일반회원 선출
- [인사]얼라인 테크놀로지, 아시아 태평양(APAC) 총괄에 한준호 대표 임명
- [동정]순천향대 부천병원 이영구 교수팀, 대한당뇨발학회 ‘우수 학술상’ 수상
- [동정]국립암센터 김영우 교수, 국제암연구소(IARC) 학술위원회 위원장 선출
- [동정]강동경희대학교병원 조대진·배성수 교수팀, 대한신경외과학회 ‘최우수 학술상’ 수상
- [동정]충북대학교병원 김존수 교수, 희귀질환 등록 통계 부문 '질병관리청장 표창' 수상
- [인사]질병관리청 승진 및 전보 (3/9)
- [인사]전남대병원, 화순병원장·치과병원장·화순군립요양병원장 임명
- [인사]얼라인 테크놀로지, 아시아 태평양(APAC) 총괄에 한준호 대표 임명
- [인사]베리스모 테라퓨틱스, 데니스 윌리엄스 규제전략총괄 부사장 영입
- [인사]한독, 2026년 임원 인사 발표
- [인사]GC녹십자의료재단, 김선주 영남센터 원장 임명
- [인사]경희의료원·강동경희대학교병원 원장인사(3/1)
- [인사]강동경희대학교병원 인사(3/1)
- [인사]엔자임헬스, 컨슈머헬스 PR사업본부 신설 등 인사 단행
- [인사]연세대학교 의료원 인사(3/1)
- [동정]휴젤, ‘2025년 코스닥시장 공시우수법인’ 선정
- [동정]고대 구로병원 안과 송종석 교수 연구팀, 아시아태평양안과학회 Best Scientific Paper Award 수상
- [동정]고려의대 융합의학교실 최낙원 교수, 한국공학한림원 일반회원 선출
- [동정]순천향대 부천병원 이영구 교수팀, 대한당뇨발학회 ‘우수 학술상’ 수상
- [동정]국립암센터 김영우 교수, 국제암연구소(IARC) 학술위원회 위원장 선출
- [동정]강동경희대학교병원 조대진·배성수 교수팀, 대한신경외과학회 ‘최우수 학술상’ 수상
- [동정]충북대학교병원 김존수 교수, 희귀질환 등록 통계 부문 '질병관리청장 표창' 수상
- [동정]동산병원 바이오브레인엔지니어링 연구팀, 대한뇌혈관내치료의학회 ‘SCIE 부문 학술상’ 수상
- [동정]경상국립대학교병원 손선우 간호사, 대한간호협회 ‘간호학술상 우수상’ 수상
- [동정]이대서울병원 백세현 교수 연구팀, APBCS ‘최우수 초록 포스터상’ 수상