-

온코닉테라퓨틱스, 금년 매출 1118억원 전망
온코닉테라퓨틱스가 직접 허가 신약 ‘자큐보’의 상업화 성과를 기반으로 매출과 영업이익의 동반 급성장을 실현하며 국내 바이오 업계에서 보기 드문 성장 사례로 주목받고 있다. 온코닉테라퓨틱스는 5일 공시를 통해 2026년 매출 1118억원, 영업이익 265억원을 기록할 것으로 전망했다. 이는 2025년 매출 534억원, 영업이익 126억원 대비 두 배에 가까운 증가폭으로, 상장 직후부터 상업화 신약이 실적을 직접 견인하는 구조가 빠르게 안착됐다는 평가다. 해당 수치는 상장 당시 증권신고서에 제시된 추정치를 크게 상회하는 수준으로, 시장의 예상을 뛰어넘는 성과 흐름이 이어지고 있다. 국내 바이오 산업에서는 기술이전 계약에 따른 일회성 마일스톤 수익으로 단기간 실적이 급증하는 사례는 존재해 왔지만, 기술특례 상장 초기부터 대형 매출과 영업이익이 매년 안정적으로 창출되며 고성장을 이어가는 사례는 드물다는 점에서 온코닉테라퓨틱스의 이번 실적 전망은 차별성을 가진다는 분석이다. 성장의 핵심은 전 세계 약 40조원 규모 시장을 보유한 국내 37호 신약 위식도역류질환 치료제 ‘자큐보’다. 자큐보는 2024년 10월 출시 이후 빠르게 처방 시장에 안착했다. 유비스트(UBIST
- 노영희 기자
- 2026-02-05 11:32
-
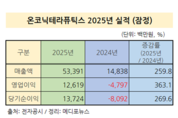
온코닉테라퓨틱스, 매출 534억원·영업이익 126억원 실적 발표
온코닉테라퓨틱스가 자체 개발 신약의 상업화를 통해 매출과 이익이 동시에 크게 증가했다. 연구개발(R&D) 비용을 정상적으로 집행한 상태에서도 흑자 구조를 달성하는 등 국내 바이오기업 가운데 드문 신약 기반 수익 창출과 후속 연구개발로 이어지는 선순환 구조를 실적으로 입증했다. 온코닉테라퓨틱스는 지난해 매출액 및 손익구조가 30% 이상 변동됨에 따라 지난해 연간 매출 534억원과 영업이익 126억원을 기록했다고 2일 관련 공시를 통해 밝혔다. 온코닉테라퓨틱스의 2025년 매출액은 약 534억원으로 전년 대비 259.8% 급증했다. 영업이익은 약 126억원을 기록하며, 전년 영업손실 47억 9779만 원에서 흑자 전환에 성공했다. 당기순이익 역시 137억 2422만원을 기록하며 흑자로 돌아섰다. 이번 실적은 국내 37호 신약인 위식도역류질환 치료제 ‘자큐보’의 매출 성장과 중국 임상3상 성공 및 허가신청에 따라 중국파트너사인 리브존(Livzon)으로부터 수취한 기술이전 마일스톤 수익이 반영된 결과다. 자큐보는 2024년 10월 출시 이후 처방 시장에서 빠르게 성장하고 있다. 유비스트(UBIST) 원외처방 데이터에 따르면 자큐보의 월 처방액은 2024년 1
- 노영희 기자
- 2026-02-02 14:18
-

온코닉테라퓨틱스 자큐보, 위궤양 치료 효과 재입증
P-CAB 신약 ‘자큐보’의 임상 3상 연구결과가 SCI급 국제 학술지에 게재되며 높은 치유율과 임상적 안전성을 다시 한 번 입증했다. 온코닉테라퓨틱스는 차세대 위산분비 억제제 자큐보정(zastaprazan, JP-1366)의 위궤양 환자 대상 임상 3상 연구 결과가 국제 학술지 Gut and Liver에 게재 됐다고 23일 밝혔다. 게재된 논문 ‘Randomized, Double-Blind, Active-Controlled, Parallel, Phase 3 Clinical Trial for Evaluating the Efficacy and Safety of Zastaprazan in Patients with Gastric Ulcers’에 따르면 자큐보는 높은 궤양 치유율과 임상적 안전성 프로파일을 확인된 것으로 나타났다. 이번 연구는 국내 39개 의료기관에서 위궤양 환자 329명을 대상으로 수행된 무작위 배정, 이중맹검 임상시험으로, 자큐보 20mg을 최대 8주간 투여해 치료 효과와 안전성을 종합적으로 평가했다. 연구결과, 8주 치료 후 모든 자큐보 투여군 환자(100%)에서 내시경적 궤양 치유가 확인돼 매우 높은 위궤양 치료 완성도를 보였다. 특히 투여
- 노영희 기자
- 2026-01-23 10:35
-

온코닉테라퓨틱스 항암신약후보 ‘네수파립’, 난소암 임상 2상 IND 승인
온코닉테라퓨틱스의 항암신약 후보물질 ‘네수파립’이 췌장암, 자궁내막암에 이어 이번엔 난소암으로 임상 2상에 돌입한다. 온코닉테라퓨틱스는 차세대 합성치사 이중표적 항암신약 후보물질 ‘네수파립’의 신규 적응증인 난소암에 대한 임상 2상 시험계획(IND)을 식품의약품안전처로부터 승인받았다고 20일 밝혔다. 이에 따라 온코닉테라퓨틱스는 세브란스병원을 포함한 국내 주요 상급종합병원에서 환자 등록 및 투약 준비에 돌입한다. 특히 이번 임상은 기존 난소암에 대한 표준치료 가이드라인에는 없던 재유지요법이라는 새로운 표준치료 적응증을 창출하기 위한 연구가 진행된다. 기존 PARP 저해제 유지요법 후 새로운 ‘재유지요법’을 이번 임상을 통해 직접 검증함으로써 재발성 난소암 치료의 새로운 옵션을 제시하는 것을 목표로 하고 있다. 약 87명 규모로 설계된 이번 임상 2상은 기존 1세대 PARP 단독 저해제 치료 후 재발하거나 내성을 보인 난소암 환자군을 대상으로 진행된다. 온코닉테라퓨틱스는 지난해 6월 바이오 산업내 최고기업인 셀트리온과 체결한 공동연구개발계약에 따라 네수파립과 셀트리온의 항혈관신생억제제 베그젤마(Vegzelma)와의 병용요법을 통해 ▲안전성 ▲내약성 ▲항종양 효
- 노영희 기자
- 2026-01-20 18:11
-

온코닉, 전이성 위암 공략 본격화…‘네수파립’ 임상 1b/2상 진입
온코닉테라퓨틱스는 차세대 합성치사 이중표적 항암신약 후보물질 ‘네수파립(Nesuparib)’의 신규 적응증인 재발·전이성 위암을 대상으로 한 임상 1b/2상 시험계획(IND)을 식품의약품안전처로부터 승인 받았다고 17일 밝혔다. 이번 임상은 네수파립과 기존 화학항암제인 이리노테칸 병용요법을 통해 안전성, 내약성 및 유효성을 평가하는 것을 목표로 한다. 국내 주요 상급병원을 중심으로 치료제가 부족한 3차 이상 치료 경험이 있는 재발·전이성 위암 환자를 대상으로 진행될 예정이다. 이번 IND 승인은 치료 대안이 매우 제한적인 진행성 위암 분야에서 네수파립의 임상적 가능성을 본격적으로 검증하는 중요한 전환점으로 평가된다. 회사는 이번 승인을 계기로 환자 등록 및 투약 준비에 착수하며, 본격적인 임상시험 운영에 돌입할 계획이다. 세계보건기구(WHO) 산하 국제암연구소(IARC)가 지난해 발간한 ‘GLOBOCAN 2022’에 따르면, 위암은 연간 96만 8734명의 신규 환자가 발생하고 66만 175명이 사망해, 전 세계 32개 암종 가운데 발생률과 사망률 모두 5위를 기록했다. 이는 연간 약 32만명의 신규 환자가 발생해 18위에 해당하는 난소암과 비교해 약 3배
- 노영희 기자
- 2025-12-17 10:23
-

온코닉테라퓨틱스, 2026 JP모건 헬스케어 컨퍼런스 2년연속 참석
온코닉테라퓨틱스는 오는 2026년 1월 12일부터 15일(현지 시각) 미국 샌프란시스코에서 열리는 ‘2026 JP모건 헬스케어 컨퍼런스’에 2년 연속 공식 초청받아 참가한다고 11일 밝혔다. JP모건 헬스케어 컨퍼런스는 매년 1월 샌프란시스코 웨스틴 세인트 프란시스(the Westin St. Francis) 호텔에서 개최되는 업계 최대 규모의 헬스케어 투자 행사로, 전 세계 주요 빅파마와 바이오 기업, 글로벌 투자자들이 대거 참여한다. 이 행사의 공식 초청은 글로벌 무대에서 기업의 기술력과 성장성을 인정받는 일종의 ‘인증 효과’를 갖는다. 특히 JP모건으로부터 초청받은 기업만 행사장 입장이 가능한 ‘익스클루시브’ 행사인 만큼, 이번 연속 초청은 회사의 기술 경쟁력에 대한 해외 시장의 신뢰를 다시 확인한 것으로 평가된다. 온코닉테라퓨틱스의 연속 초청 배경에는 차세대 합성치사 이중표적 항암신약 후보 ‘네수파립’의 연구·임상 성과가 결정적으로 작용한 것으로 보인다. 온코닉테라퓨틱스는 2021년 ASCO(미국임상종양학회)에서 다암종 임상 1상 데이터를 처음 공개한 이후, AACR(미국암연구학회), ASCO 등 주요 국제 암학회에서 매년 후속 연구·임상 결과를 발표하
- 노영희 기자
- 2025-12-11 12:17
-

온코닉 P-CAP 신약 자큐보, 구강붕해정 제형 허가
P-CAB신약 ‘자큐보’에 구강붕해정 제형이 새롭게 추가되며 성장세가 더욱 가속화될 전망이다. 온코닉테라퓨틱스는 위식도역류질환 P-CAB(칼륨 경쟁적 위산분비 억제제) 신약 ‘자큐보’(성분명 : 자스타프라잔) 구강붕해정(Orally Disintegrating Tablet, ODT)의 국내 신규품목허가(NDA)를 식품의약품안전처로부터 승인받았다고 31일 밝혔다. 자큐보 구강붕해정은 온코닉테라퓨틱스가 지난해 4월 허가받아 시판 중인 신약 제37호 ‘자큐보’의 새로운 제형이다. 환자 복용 편의성 강화를 목표로 올해 4월 품목허가를 신청해 약 6개월 만에 승인을 획득했다. 구강붕해정은 물 없이 입안에서 빠르게 녹여 복용할 수 있는 제형으로, 식도연하 운동 저하로 정제 삼킴이 어려운 고령환자나 즉각적인 복용이 필요한 상황에 최적화를 위해 개발됐다. 특히 구강붕해 제형에 많이 사용되는 민트향이 오히려 위식도역류환자에게는 속쓰림을 유발할 수 있다는 점을 고려해 오렌지향을 적용해 복약 순응도를 높였다. 온코닉테라퓨틱스는 이번 허가로 P-CAB 계열 위식도역류질환 치료제 가운데 구강붕해정을 보유한 세계 두 번째 기업이 됐다. 빠른 개발 속도와 기술적 완성도를 입증한 만큼,
- 노영희 기자
- 2025-10-31 09:38
-

온코닉테라퓨틱스 네수파립, 췌장암 치료 연구결과 IJBS 게재
온코닉테라퓨틱스가 개발 중인 췌장암 신약의 전임상 결과가 국제학술지에 게재되며 연구성과를 세계적으로 인정받았다. 온코닉테라퓨틱스는 차세대 합성치사 이중표적 항암신약 후보 ‘네수파립(JPI-547)’의 췌장암 전임상 연구 결과가 SCI급 국제 학술지 IJBS(International Journal of Biological Sciences)에 게재됐다고 10일 밝혔다. IJBS는 생명과학·분자생물학·생화학 분야에서 SCI 상위 10%에 속하는 세계적 권위의 학술지다. 인용 지수와 저널 영향력 모두 글로벌 최고 수준으로, 전 세계 연구자들로부터 높은 신뢰와 인지도를 확보하고 있다. 이번 게재는 네수파립의 연구 성과가 국제적으로 공인된 과학적 가치를 인정받았음을 의미한다. IJBS에 게재된 이번 연구는 서울대학교 의과대학 종양내과 오도연 교수 연구팀이 주도했으며, 췌장암 유지요법으로 허가받은 기존 PARP(Poly ADP-ribose polymerase) 단독 저해 기전 항암제의 한계를 넘어서는 치료 확장성을 입증했다는 평가다. 네수파립(Nesuparib)은 Tankyrase와 PARP를 동시에 억제하는 기전을 통해 암세포 성장 경로와 DNA 복구를 차단하는 차세대
- 노영희 기자
- 2025-10-10 09:48
-

온코닉-셀트리온, 네수파립+베그젤마 공동연구 임상 2상 IND 신청
온코닉테라퓨틱스가 글로벌 난소암 치료 패러다임을 바꿀 병용요법 임상에 시동을 걸었다. 온코닉테라퓨틱스는 차세대 이중저해 합성치사 항암신약 후보물질 ‘네수파립(Nesuparib)’과 셀트리온의 항암제 바이오시밀러 ‘베그젤마(성분명: 베바시주맙, Bevacizumab)’ 병용요법에 대한 국내 임상 2상 시험계획(IND)을 식품의약품안전처에 신청했다고 1일 밝혔다. 이번 임상 2상은 기존 난소암 표준 유지요법인 PARP단독저해 항암제 사용 후 백금치료가 마지막 치료제가 되는 상황에서 네수파립과 베그젤마 병용을 통해 재유지요법이라는 기존에 없던 치료 기회를 새롭게 창출함으로써 난소암분야의 높은 미충족 의료수요 해결에 도전하는 것으로 그 의미가 크다. 온코닉테라퓨틱스는 이번 임상 2상을 통해 네수파립과 셀트리온의 베그젤마와의 병용 투여 신규 재유지요법의 안전성, 내약성, 항종양 효과를 종합적으로 검증하는 데 초점을 맞췄다. 네수파립은 암세포의 DNA 손상 복구를 담당하는 PARP(Poly ADP-ribose polymerase)와 암 성장·증식에 관여하는 Tankyrase를 동시에 저해하는 차별화된 이중저해 기전의 차세대 합성치사 항암신약 후보물질이다. 현재 온코닉테
- 노영희 기자
- 2025-10-01 17:39
-

온코닉 차세대 췌장암 신약 후보 ‘네수파립’ 임상2상 진입 허가
온코닉테라퓨틱스가 글로벌 시장을 겨냥해 개발중인 췌장암 신약 임상에 가속도가 붙었다. 온코닉테라퓨틱스는 차세대 합성치사 이중표적 항암신약 후보물질 ‘네수파립’의 국소 진행성/전이성 췌장암 대상 임상 2상 시험계획(IND)을 식품의약품안전처로부터 승인 받았다고 29일 밝혔다. 이번 임상 2상은 1b상에서 확인된 안전성, 내약성 및 항종양 효과를 기반으로, 네수파립과 표준치료요법 병용투여로 1차 치료제로서의 항종양 효과와 안전성을 검증하는 것을 목표로 한다. 이에 따라 온코닉테라퓨틱스는 환자 모집 및 투약 준비에 착수해, 전세계적으로 미충족 의료수요가 큰 국소 진행성/전이성 췌장암에 대한 차세대 치료옵션으로서의 과학적 근거를 빠르게 확보해 항암신약으로서의 가치를 입증할 계획이다. ‘네수파립’은 Tankyrase와 PARP를 동시에 억제하는 퍼스트 인 클래스(First-in-class) 이중표적 합성치사 항암신약 후보물질로, 온코닉테라퓨틱스가 독자 개발 중인 핵심 파이프라인이다. ‘네수파립’은 지난 2021년 췌장암에 대해 미국 FDA로부터 희귀의약품(Orphan Drug Designation, ODD) 지정을 획득한 데 이어, 국내 식약처로부터도 췌장암 개발단계
- 노영희 기자
- 2025-09-29 14:10
- [인사]셀트리온그룹 임원승진인사 (2/13)
- [동정]인천성모병원 허휴정 교수, 지역 정신건강 증진 공로로 인천광역시장 표창
- [동정]고대 안암병원 김태훈 연구부원장, 서울시의회의장 표창 수상
- [인사]이무식 교수, 제19대 건양의대 학장 취임
- [부음]류호경 나라치과 원장 장모상
- [동정]김원섭 충북대학교병원장, 보건복지부장관 표창
- [동정]유한양행, 23년 연속 존경받는 기업 제약부문 1위 수상
- [인사]티씨노바이오사이언스, 정진아 신임 개발본부장(CDO) 영입
- [부음]한원선 前 한원선신경정신과의원 원장 별세
- [동정]인천성모병원 이운정교수, 응급의료 공로로 소방청장 표창
- [인사]셀트리온그룹 임원승진인사 (2/13)
- [인사]이무식 교수, 제19대 건양의대 학장 취임
- [인사]티씨노바이오사이언스, 정진아 신임 개발본부장(CDO) 영입
- [인사]서울성모병원 장기육 교수, 대한심혈관중재학회 차기 회장 추대
- [인사]영남대 영천병원, 제18대 박삼국 병원장 취임
- [인사]명지병원, ‘뇌졸중 전문가’ 최영빈 교수 영입
- [인사]동산의료원·동산병원·대구동산병원 보직인사(2/1)
- [인사]삼성서울병원, 원장단 및 주요 보직 인사(2/1)
- [인사]배재훈 교수, 계명대학교 동산의료원장 취임
- [인사]동화약품, 장재원 연구개발본부장 선임
- [동정]인천성모병원 허휴정 교수, 지역 정신건강 증진 공로로 인천광역시장 표창
- [동정]고대 안암병원 김태훈 연구부원장, 서울시의회의장 표창 수상
- [동정]김원섭 충북대학교병원장, 보건복지부장관 표창
- [동정]유한양행, 23년 연속 존경받는 기업 제약부문 1위 수상
- [동정]인천성모병원 이운정교수, 응급의료 공로로 소방청장 표창
- [동정]충남대병원 박재호 물리치료사, 연구논문 국제학술지 게재
- [동정]경희대병원 여승근 교수, 대한민국의학한림원 정회원 선출
- [동정]건양대병원 차아름 씨, 외국인 환자 유치 유공 대전시장 표창
- [동정]세종충남대병원 박재형・오진경 교수, 대한내과학회 수여 ‘KJIM 최다인용 공로상’ 선정
- [동정]범석학술장학재단, 제29회 범석상에 김병극·김승현 교수 선정









