[종양내과] 면역항암제의 원리와 진료현장에서의 사용 현황
박인근 (가천의대 길병원 종양내과 )
- 박인근 medifonews@medifonews.com
- 등록 2022-08-25 09:56:19

서론
암세포는 우리 몸의 정상세포에서 발생하며, 통제를 벗어난 지속적 세포분열과 주위조직 침범, 원격전이를 특징으로 한다. 비록 자기자신의 세포에서 발생하지만, 돌연변이가 누적되며 정상적인 체세포와는 점차 다른 성질을 갖게 된다. 그러한 성질 중에는 이전에는 존재하지 않았던 새로운 항원(neoantigen)을 합성하거나 태아항원과 같이 정상세포에는 발현이 억제되었던 항원을 재발현 하거나, 특정 항원을 과발현하는 것도 포함된다. 면역체계는 기본적으로 자기와 비-자기 (self vs. non-self)를 구분하여 비자기를 공격하여 자기를 보호하는데, 자기자신에서 발생하였지만 자기와 다르게 변한 암세포를 정상세포와 구별하여 제거하는 항종양 면역기전도 존재하며, 이에 대한 연구와 치료적용에 큰 도약이 일어나고 있다.
면역체계가 종양의 억제에 관여한다는 간접적 증거는 많은데, 가령 장기간 면역억제제를 사용하면 암발생이 증가하며, 드물지만 진행성 암이 진단된 후 아무런 치료도 하지 않았는데 저절로 암이 사라지는 경우가 보고되어 왔으며, 심한 감염을 앓고 난 이후 (항진된 면역체계에 의하여) 암이 좋아지는 경우가 관찰되어 왔다. 작용기전은 명확히 몰랐었으나, 이미 1890년대에 William Coley는 streptococcus pyogenes와 Serratia marcescens의 혼합물인 Coley’s toxin이라는 치료제를 육종에 사용해 항암효과를 보고하기도 하였다. 이후 종양면역치료는 한동안 별다른 진전이 없다가 1970년대 방광암에서 BCG 방광내 주입 치료의 효과가 입증되었고, 지금도 표준으로 받아들여지고 있다.
현재는 종양학과 면역학을 결합한 종양면역학(immunooncology)이라는 학문 분야가 생길 정도로 연구, 임상시험, 약물개발과 치료 적용이 매우 활발하게 이루어지고 있다. 이러한 발전에는 항종양면역체계(종양-면역 주기)의 이해((Fig. 1)와 종양-면역 주기의 각 단계에서 종양세포가 항종양면역체계를 회피하는 기전(암면역편집, cancer immunoediting)을 밝혀낸 것이 중요한 역할을 하고 있고, 각각의 기전을 억제하는 약물을 개발하여 현재 진료실에서 활발히 사용 중이거나 임상시험 중인 약이 매우 많다. 전세계적으로 진행중인 면역항암제 임상시험의 수가 2020년에 6,000개 이상으로 집계되었다.
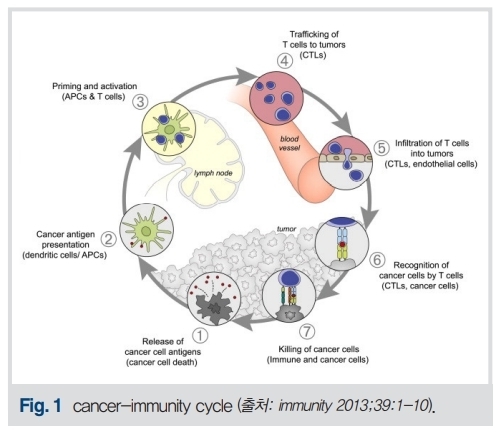
항원제시세포가 암세포에서 암항원을 인지하여 암 주변의 림프절에서 T림프구에 전달하여 활성화시키면, T세포는 세포독성림프구로 변환되어 혈류를 타고 암세포에 침투하여 암항원을 발현하는 암을 제거한다. 종양세포는 면역편집(cancer immunoediting)이라는 기전을 통하여 이러한 각각의 단계를 회피하는 방법을 진화시키게 된다.
면역항암제의 종류와 원리
종양면역학 분야에서 항종양 면역반응의 기전들이 조금씩 밝혀지면서, 항종양 효과를 높여 암을 치료하기 위한 많은 노력이 있어왔다. 다양한 종류의 면역항암치료제가 있고, 분류는 기준을 어떻게 정하느냐에 따라 조금씩 달라질 수는 있다(Table 1).
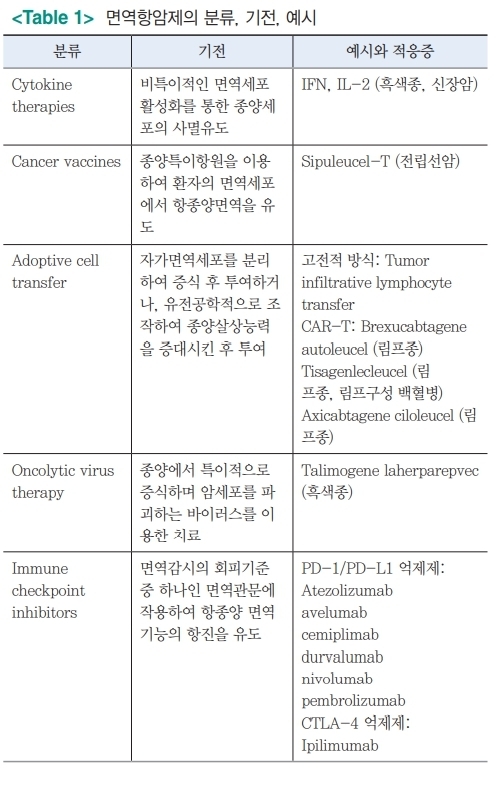
초기에는 비특이적 면역활성화를 일으키는 interferon이나 cytokine이 주를 이루었으나, 효과나 높지 않고 부작용이 상당하여 최근에는 거의 사용되고 있지 않으며, 부작용을 줄이거나 효과를 높이는 방식으로 개선하는 약제가 개발 중이다.
특정 감염원에 대한 면역반응을 유도하기 위해 백신을 투여하듯, 암백신은 암특이항원을 이용해 암에 대한 면역반응을 유도하는 방법이다. 매우 다양한 암종에서 다양한 항원에 대한 치료제 개발이 시도되었지만, 현재는 전립선암에서 사용중인 Sipuleucel-T가 유일하게 FDA허가를 받은 약제이다.
입양세포치료(adoptive cell therapy)는 체내 림프구나 NK세포 등을 채집하여 분리, 증식시킨 후 다시 주입하는 방식인데, 이전 종양침윤림프구를 분리증식 후 주입하는 방식에서 발전하여 T림프구에 유전공학을 이용해 키메라항원수용체 (chimeric antigen recetor, CAR)를 부착시켜 주입시키는 CAR-T치료가 각광을 받고 있으며 현재 혈액암에서 사용되고 있다.
종양용해성 바이러스치료 (oncolytic virus therapy)란 암에 특이적으로 감염되어 암세포내에서 증식하며 암세포를 파괴하면서 다른 암세포를 감염시켜 나가는 치료용 바이러스이며, 유전공학을 이용하여 다양한 바이러스가 개발되고 있으며 현재 흑색종에서 사용하는 T-VEC(talimogene laherparepvec)이 대표적이다.
가장 다양한 암종에서 사용되고 있는 면역항암제는 면역관문억제제이다. 면역관문이란, 면역세포가 특정항원을 인지 후 공격할지 말지를 정하는 과정에 관여하는 일련의 세포표면 수용체-리간드 집합이며, 이들 중 대표적으로 공동억제신호를 보내 항종양 면역반응을 억제시키는 PD-1/PD-L1, 그리고 CTLA-4를 억제하는 약물이 실제 사용중이며, 이들 이외에도 매우 다양한 면역관문이 있고 치료제가 개발중이다.
진료현장에서 사용 중인 면역항암제와 적응증
앞서 이야기하였듯, 현재 고형암의 치료에서 진료실에서 활발히 사용중인 것은 PD-1/PD-L1 억제제(옵디보, 키트루다, 티센트릭 등)와 CTLA-4억제제(여보이)가 있다. 매우 다양한 암종에서 허가를 받았으며, 일부 암종에서는 건강보험적용도 되고 있다. 약제 적응증으로 허가된 암종을 일부만 예로 들자면 흑색종, 신장암, 폐암, 방광암, 비호지킨림프종, 간암, 삼중음성 유방암, 두경부 암 등 거의 모든 암을 망라하며, 현재 면역항암제는 가장 활발하게 임상시험이 진행되고 있는 분야이므로 앞으로도 얼마나 많은 암종에서 사용될지 예측이 어렵다. 면역항암제의 항종양 반응의 특징은 반응율이 아주 높지는 않지만 (대략적으로 20~30%정도), 일단 반응이 있는 경우 매우 오랜 기간 지속된다는 것이다.
매우 다양한 암종에서 사용되기 때문에 종양내과 이외의 과에서나 개업가에서도 언제라도 면역항암제로 치료받는 환자를 마주칠 수 있으며, 해당 약제의 부작용을 몰라보는 경우 조기에 치료시기를 놓쳐 매우 중대한 합병증으로 이어지거나 심한 경우 사망까지 이를 수도 있으므로, 다음 단락에 나올 부작용에 대해서는 알아 놓는 것이 좋다.
면역학적 부작용
기존의 치료제들은 매우 예측 가능하고 전형적인 부작용을 나타냈었다. 가령 세포독성 항암제는 빠르게 분열하는 세포에 작용하여 탈모, 혈액학적 부작용, 점막부작용 등이 기본으로 나타나고, 식욕부진, 기력저하 등이 동반되며, 표적치료제는 암에 과발현되는 표적일지라도 정상세포에도 어느 정도 발현되므로 표적을 발현하는 정상세포에 대한 독성이 나타난다(가령 EGFR억제제는 피부독성이 대표적이며, HER2억제제는 심장독성이 나타날 수 있다).
면역항암제는 림프구의 항종양면역반응을 항진시키는 기전으로 작용하며, 면역반응 항진이 종양특이적으로 나타나는 것은 아니다. 따라서 자가면역질환과 비슷한 면역관련부작용(immune-related adverse event)가 발생할 수 있으며, 발생 부위는 전신의 모든 부위라고 할 수 있을 만큼 광범위하다(Fig. 2).
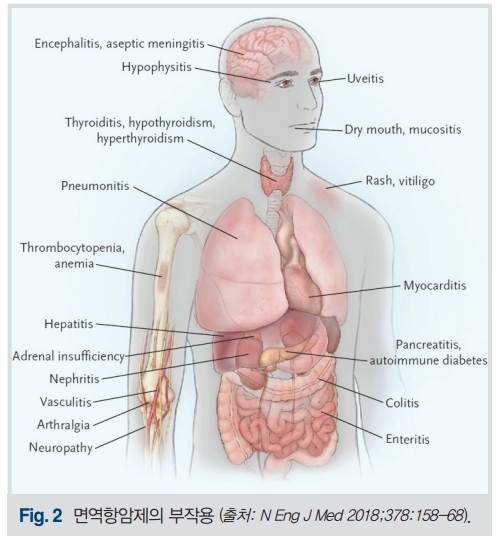
가장 흔한 것은 장염(설사, 혈변), 간질성 폐렴(기침, 호흡곤란), 간염, 내분비이상(갑상선기능이상, 부신피질기능저하, 뇌하수체염 등)이며, 드물지만 뇌염, 망막염, 심근염, 골수이상 등도 나타날 수 있다. 특이하게도, 이런 부작용들은 치료를 시작하고 나서 2~3개월 이후 나타나는 경우가 많아 초반에 이상이 없다고 부작용이 없을 것이라고 단정할 수 없다. 다행인 것은 이러한 면역관련 부작용은 발생빈도가 높지는 않으며(PD-1/PD-L1억제제 단독사용시 10~20%, CTLA-4억제제 사용시 30%내외, 병합요법 시 40% 내외), 대개의 경우 경도의 부작용으로 나타나고 일부에서 심하게 발생하더라도 조기에 발견하여 적절한 조치를 취하면 호전될 수 있다는 것이다. 면역항암제가 이런 부작용을 나타낼 수 있다는 것을 인지하고 있지 못할 경우 치료 시기를 놓칠 수 있으므로, 진료하는 환자가 암을 진단받고 치료 중이라면 치료제가 무엇인지 반드시 확인하고, 증상이 심하거나 대증치료에도 불구하고 개선되지 않을 경우 조기에 치료중인 병원으로 의뢰하는 것이 바람직하다. 면역학적 반응에 의한 부작용이므로, 치료는 약제의 중단과 면역억제제의 사용이며, 내분비기관 독성은 호르몬대체요법을 사용하는 것이다. 면역관련 부작용 이외에도 피로감, 식욕부진, 오심 등 가벼운 부작용도 비교적 흔하게 나타난다.
사실상 머리에서 발끝까지 어떠한 장기에도 발생이 가능하다. 빈도가 높지는 않고 심각한 부작용은 흔하지는 않지만 조기진단과 치료개시가 중요하다.
결론
세포독성항암제와 표적치료제의 발전에도 불구하고 정체기에 있었던 종양내과학 분야에서, 면역항암제는 매우 큰 변화를 일으키며 표준치료로 자리를 잡았다. 매우 다양한 암에서 사용되고 있으며, 아직까지는 대상환자 중 일부에서만 항종양 반응을 보이고 있지만 반응이 있으면 매우 장시간 유지되는 장점이 있다. 면역학적 독성이 발생하지만 심한 독성은 드물며, 세포독성 항암제나 표적치료제 같은 기존의 치료제에 비하여 부작용 빈도면에서나 삶의 질 측면에서 유리하다. 최근에는 세포독성 항암제나 표적치료제와의 병합요법도 적극적으로 개발되고 있어서, 향후 더 넓은 암종에서 다양한 병합요법으로 사용될 것으로 생각된다.
Reference
1.Yuanyuan Zhang et al. The history and advances in cancer immunotherapy: understanding the characteristics of tumor-infiltrating immune cells and their therapeutic implications. Cell Mol Immunol 2020;17:807-821
2.Daniel Chen et al. Oncology meets immunology: the cancer-immunity cycle. Immunity 2013;39:1-10
3.Samik Upadhaya et al. Immuno-oncology drug development forges on despite COVID-19. Nat Rev Drug Discov 2020;19:751-752
4.Julianne Twomey et al. Cancer immunotherapy update: FDA-approved checkpoint inhibitors and companion diagnostics. AAPS J 2021;23:39
5.Michael Postow et al. Immune-related adverse events associated with immune checkpoint blockade. N Eng J Med 2018;378:158-68
- [부음]김권식 메디포뉴스 전무 빙모상
- [동정]인천성모병원 이순규 교수, 대한간암학회 학술대회 우수구연상 수상
- [동정]명지병원 김민석 교수, 제62차 세계흉부외과학회 ‘Maxwell Chamberlain 논문상’
- [동정]고대 구로병원 병리과, 서울특별시장 표창·서울시의회 의장상 동시 수상
- [부음]이학철 前 부산시한의사회 회장·이학종 분당서울대병원 의생명연구원장 부친상
- [동정]한림대성심병원 하상욱 권역응급의료센터장, 소방청장 표창 수상
- [동정]경북대병원 손상균 교수, 대한민국의학한림원 정회원 선출
- [인사]서울성모병원 장기육 교수, 대한심혈관중재학회 차기 회장 추대
- [동정]서울대병원 이창현 교수팀, 대한척추변형연구회 ‘서봉 최우수 학술상’ 수상
- [인사]영남대 영천병원, 제18대 박삼국 병원장 취임
- [인사]서울성모병원 장기육 교수, 대한심혈관중재학회 차기 회장 추대
- [인사]영남대 영천병원, 제18대 박삼국 병원장 취임
- [인사]명지병원, ‘뇌졸중 전문가’ 최영빈 교수 영입
- [인사]동산의료원·동산병원·대구동산병원 보직인사(2/1)
- [인사]삼성서울병원, 원장단 및 주요 보직 인사(2/1)
- [인사]배재훈 교수, 계명대학교 동산의료원장 취임
- [인사]동화약품, 장재원 연구개발본부장 선임
- [인사]HLB 자회사 엘레바, 김동건 대표 선임
- [인사]서울대병원 우홍균 교수, 아시아방사선종양학회연합회 회장 취임
- [인사]서울대병원 박중신 교수, 제26대 대한의학회 회장 선출
- [동정]인천성모병원 이순규 교수, 대한간암학회 학술대회 우수구연상 수상
- [동정]명지병원 김민석 교수, 제62차 세계흉부외과학회 ‘Maxwell Chamberlain 논문상’
- [동정]고대 구로병원 병리과, 서울특별시장 표창·서울시의회 의장상 동시 수상
- [동정]한림대성심병원 하상욱 권역응급의료센터장, 소방청장 표창 수상
- [동정]경북대병원 손상균 교수, 대한민국의학한림원 정회원 선출
- [동정]서울대병원 이창현 교수팀, 대한척추변형연구회 ‘서봉 최우수 학술상’ 수상
- [동정]대전을지대병원 홍민정 간호국 파트장, 소방청장 표창 수상
- [동정]고려대의료원 윤주성 팀장, 대한병원정보협회장 연임
- [동정]일산백병원 최준영 교수, ‘상병수당 제도 발전 기여’ 국민건강보험공단 이사장 표창
- [동정]아주대학교병원 교수 7명, 대한민국의학한림원 정회원 및 공헌회원 선출












