혈관 외 용혈 PNH, 다발골수종, DLBCL, 소아 신경모세포종 등 치료제 허가
2024년 6월, 식약처로부터 허가받은 의약품들 중 전문의약품의 비율이 과반을 채 넘기지 못한 것으로 나타났지만, 희귀의약품이 다수 허가되면서 약제 접근성이 제한된 질환의 환우들에게 새로운 희망을 선사했다.
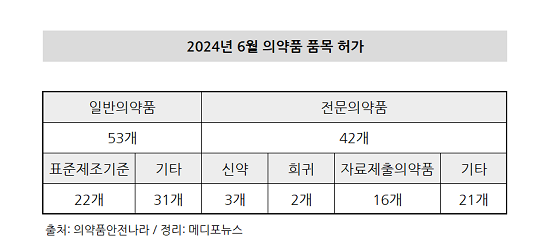
식품의약품안전처 의약품안전나라를 통해 지난 달 95건의 의약품이 허가 현황이 확인됐다. 이 중 일반의약품이 53개, 전문의약품이 42개로 전문의약품의 비율은 약 44.2%에 불과했다.
전문의약품 42개를 자세히 살펴보면 신약이 3개, 희귀질환 치료제가 2개, 자료제출의약품이 16개, 기타 품목이 21개였다.
특히 희귀의약품은 한국아스트라제네카의 성인 혈관 외 용혈 동반 발작성 야간 혈색소뇨증 치료 부가요법으로 허가받은, 경구용 D인자 저해제 ‘보이데야(성분명 다니코판)’ 100mg와 50mg였다.
발작성 야간 혈색소뇨증는 유전자 돌연변이에 의해 나타나는 희귀질환으로, 용혈 및 혈전증으로 인해 빈혈, 피로, 헤모글로빈뇨 등이 나타나며, 사망에 이를 수 있다. 치료 과정에서 결함이 있는 적혈구가 C3에 축적될 경우 혈관 외 용혈이 발생할 수 있는데, 이 경우 발작성 야간 혈색소뇨증 환자 10명중 1~2명은 수혈이 필요할 만큼 심각한 것으로 알려졌다.
허가의 근간이 된 ALPHA 연구에 따르면 보이데야는 베이스라인 대비 12주차 헤모글로빈 농도 변화에서 보이데야는 2.94g/dL, 위약은 0∙50g/dL으로 나타났으며, 보이데야와 위약 간의 LSM 차이는 2.44g/dL였다. 특히 보이데야와 위약 간의 평균 헤모글로빈 농도 차이는 치료 1주차부터 나타난 것으로 확인됐다.
허가심사유형이 희귀 부문으로 분류되지는 않았지만, 한국얀센의 다발골수종 치료제 ‘탈베이주(성분명 탈쿠에타맙)’도 2mg/mL, 2mg/mL에 대해 허가를 받았다. 탈베이주는 프로테아좀억제제, 면역조절제제, 항-CD38 단클론항체를 포함해 적어도 3차 이상의 치료를 받은 재발 또는 불응성 다발골수종 성인 환자가 사용할 수 있다.
MonumenTAL-1 연구서는 이전에 T세포 재유도 치료 경험이 없는 총 143명의 환자가 0.4mg/kg을 매주 투여받았는데, 이 환자군의 전체반응률은 74.1%, 엄격한 완전관해는 24%로 분석됐다. 완전관해와 매우좋은 부분관해를 나타낸 환자는 각각 10%, 26%이었다.
이전에 T세포 재유도 치료 경험이 없고, 0.8mg/kg을 격주로 투여 받은 환자는 총 145명이었으며, 이 환자군의 전체반응률은 71.7%, 엄격한 완전관해는 30%로 확인됐다. 완전관해와 매우좋은 부분관해를 나타낸 환자는 각각 9%, 22%이었다.
한국애브비는 두 가지 이상 전신치료 후 재발성 또는 불응성 미만성 거대 B세포 림프종에 사용되는 치료제 ‘엡킨리(성분명 엡코리타맙)’의 4mg/0.8mL, 48mg/0.8mL 용량을 허가받았다.
비무작위 배정 단일군 임상시험 EPCORE™ NHL-1에 따르면 유효성은 임상에서 4주기(1주기 28일) 동안 피하투여한 157명 환자를 대상으로 평가됐으며 추적 기간 중앙값은 15.7개월이었다.
EPCORE™ NHL-1 연구에 포함된 미만성 거대 B세포 림프종 환자 139명 대상 엡킨리 투약의 유효성을 분석한 결과, 전체 반응률은 62%로 나타났다. 완전 관해는 39% 도달했고, 반응 지속기간 중앙값은 15.5개월로 나타났으며 반응이 나타나기까지의 시간 중앙값은 1.4개월로 빠른 치료 반응을 보였다. 전체 생존기간 중앙값은 18.5개월로 나타났다
EPCORE™ NHL-1 임상시험에서는 엡킨리가 환자 삶의 질에 미치는 영향도 확인됐다. 림프종 환자의 삶의 질을 평가하기 위한 완전히 검증된 설문지 FACT-Lym을 통해 주요 림프종 증상인 신체 통증, 발열, 야간 발한, 에너지 부족, 쉽게 지침, 체중 감소 등의 개선 정도를 환자가 직접 체감하는 바를 보고했다. 그 결과 환자가 엡킨리로 치료를 받는 동안 각 증상 지표에 대한 지속적이고 일관된 개선이 관찰됐다.
이밖에도 레코르다티코리아의 소아 신경모세포종 치료제 ‘콰지바주(성분명 디누툭시맙베타)’4.5mg/mL도 허가됐다.
신경모세포종은 교감신경절 세포의 기원인 미분화한 신경모세포가 성숙‧분화하지 않아 발생하는 종양으로 주로 5세 이하의 소아에서 발생하며, 지금까지 국내에는 고위험군, 재발성‧불응성 신경모세포종 환자에 대해 허가된 치료제가 없었다.
콰지바주는 신경모세포 표면에 있는 GD2에 결합해 종양세포 사멸을 유도하는 단클론항체로, 고위험군 또는 재발성∙불응성 신경모세포종 소아 환자 치료에 사용한다.
일반의약품 53개 중에서는 표준제조기준이 22개, 기타 부문이 31개 허가를 받았다.
유한양행의 ‘안티푸라민빅파워플라스타’, 일동제약의 ‘푸레파센600정’, SK케미칼의 ‘트립에스정’과 ‘콘드로에스800정’, 광동제약의 ‘아이톡듀오점안액’, 동국제약의 ‘오라페인큐겔’, 신신제약의 ‘락토란정’과 ‘판크레정’ 등이 허가됐다.
노영희 기자 nyh2152@medifonews.com
< 저작권자 © Medifonews , 무단전재 및 재배포금지 >
- 본 기사내용의 모든 저작권은 메디포뉴스에 있습니다.
