국내 코로나19 임상시험, 어디까지 왔나
한국MSD, 뉴젠테라퓨틱스 임상 신규 승인돼
- 노영희 기자 nyh2152@medifonews.com
- 등록 2020-11-10 16:57:49
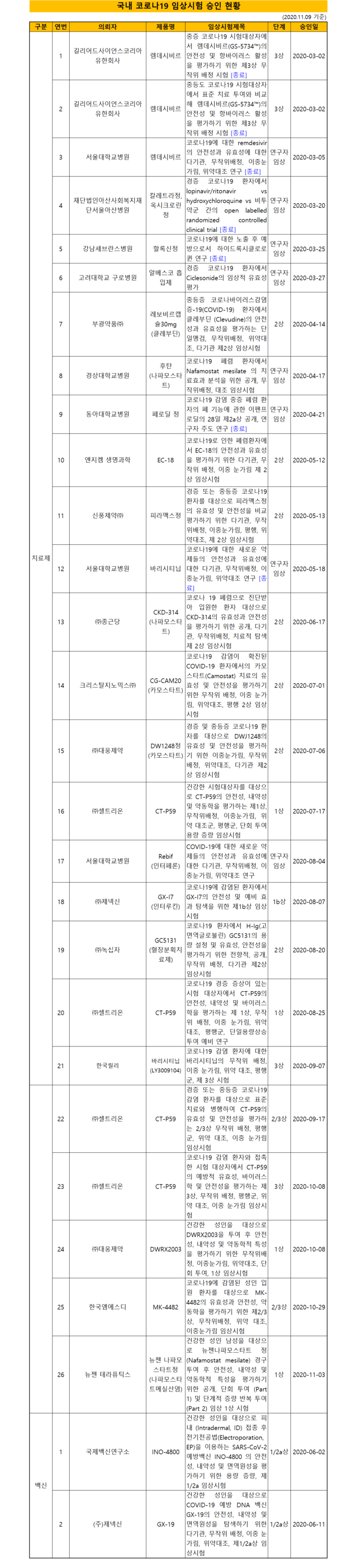
 식품의약품안전처(김강립 처장)가 제공한 국내 코로나19 치료제·백신의 임상시험 및 허가·심사 현황에 따르면, 국내에서 승인한 임상시험은 총 28건(치료제 26건, 백신 2건)이다.
식품의약품안전처(김강립 처장)가 제공한 국내 코로나19 치료제·백신의 임상시험 및 허가·심사 현황에 따르면, 국내에서 승인한 임상시험은 총 28건(치료제 26건, 백신 2건)이다.코로나19 치료제에 대한 임상시험 2건이 추가로 신규 승인됐고(10.27. 이후) 7건이 종료돼 현재 진행 중인 임상시험은 총 21건(치료제 19건, 백신 2건)이다.
제약업체가 진행하고 있는 임상시험은 18건이며, 연구자가 진행하고 있는 임상시험은 3건이다. 1상 임상시험은 항체치료제, DNA백신 등 7건, 2상 임상이 혈장분획치료제 등 9건이고, 이외에 3상 임상시험이 2건 진행 중이다.
◆ 시작하는 임상시험과 종료된 임상시험
현재 국내에서 승인한 임상시험은 총 28건(치료제 26건, 백신 2건)이다.
코로나19 치료제에 대한 임상시험 2건이 추가로 신규 승인됐고(10.27. 이후) 7건이 종료돼 현재 진행 중인 임상시험은 총 21건(치료제 19건, 백신 2건)이다.
종료된 임상은 렘데시비르 3건과 옥시크로린정·칼레트라정, 할록신정, 바리시티닙, 페로딜 각각 1건이다.
신규 승인된 임상시험은 한국엠에스디(MK-4482, 항바이러스제)의 2/3상시험(10.29. 승인)과 뉴젠테라퓨틱스(뉴젠나파모스타트정, 항바이러스제)의 1상시험(11.3. 승인)이다.
한국엠에스디의 ‘MK-4482’는 독감 치료제로 개발 중인 신약을 코로나19 치료제로 개발하는 것으로 다국가 임상시험으로 진행되고 있다.
뉴젠테라퓨틱스의 ‘나파모스타트정’은 현재 항응고제로 사용되는 주사제(나파모스타트메실산염)를 경구투여할 수 있는 정제로 개발해 복용 편의성을 개선한 제품이다.
◆ 국내에서 진행 중인 코로나19 임상시험은?
치료제로는 항바이러스제, 중화항체치료제, 혈장분획치료제, 면역조절제가 개발 중이다.
부광약품(레보비르, 항바이러스제), 엔지켐(EC-18, 면역조절제), 신풍제약(피라맥스, 항바이러스제), 대웅제약(DWJ1248, 항바이러스제), 셀트리온(CT-P59, 중화항체치료제), 녹십자(GC5131, 혈장분획치료제) 등이 환자를 모집해 임상시험을 진행하고 있다.
백신 분야에서는 제넥신(GX-19)이 환자를 모집해 임상시험을 진행하고 있다.
또한, 대체치료수단이 없는 환자에 치료기회 제공을 위해 녹십자 혈장분획치료제의 치료목적사용이 3건 승인됐다.
◆ ‘항체치료제’ 임상시험, 어디까지 왔을까?
국내에서 개발되고 있는 항체치료제로 셀트리온의 제품이 코로나19 경증~중등증 환자를 대상으로 2/3상 임상시험을 다국가 임상으로 진행되고 있다.
해외에서는 미국의 릴리와 리제네론의 제품이 코로나19 경증~중등증 환자를 대상으로 2/3상 임상시험을 진행되고 있다.
두 제품 모두 미국 FDA에 긴급사용승인을 신청(10.7.)했으며, 이 중 릴리의 제품이 11월 9일 승인을 받았다.
릴리에서 진행 중인 2상 임상시험의 중간결과 발표(10.28.)에 따르면 대조군 대비 시험군에서 증상 악화로 입원하는 비율이 감소했으며, 안전성 우려는 없는 것으로 나타났다. 다만, 별개로 진행 중인 중증환자 대상 3상 임상시험은 치료 효과가 부족한 것으로 나타나 조기에 종료(10.26.)됐다.
리제네론에서 진행 중이던 중증환자 대상 3상 임상시험은 독립적 데이터 모니터링 위원회의 권고에 따라 추가적인 안전성 평가를 위해 증상이 심각한 중증환자에 대한 등록을 지난달 30일에 중단했다.
식약처는 “코로나19 치료제·백신의 임상승인, 품목허가, 특례제조·수입 등에 대한 사항을 지원해, 우리 국민이 치료 기회를 보장받을 수 있도록 최선을 다하겠다”고 밝혔다.
- [동정]연세의대 이정윤 교수, 2026 제7회 난소암 컨센서스 컨퍼런스 공동의장 선임
- [동정]원주의과대학 이승현 연구원, 한국보건정보통계학회 학술대회 우수상
- [동정]경희대병원 유명철 교수, 대한안면신경학회 최우수상 수상
- [동정]고대 안산병원 박형준 교수, 아시아관절경학회 정기학술대회 우수 발표상 수상
- [인사]휴온스그룹, 2026년 정기 임원 인사 실시 (1/1)
- [동정]은평성모병원 최의윤 교수, 보건복지부 장관 표창
- [동정]고대 안산병원 한경화 수간호사, 응급 의료 발전 유공 안산시장 표창 수상
- [동정]서울성모병원 장기이식센터, 아태지역 최대 이식 학술대회 ‘ATW 2025’ 우수 초록상 연속 수상
- [부음]강재수 일암의료재단 삼례고려병원 이사장 별세
- [인사]고대 안암병원 이헌정 교수, 제3대 대한디지털치료학회장 선출
- [인사]휴온스그룹, 2026년 정기 임원 인사 실시 (1/1)
- [인사]고대 안암병원 이헌정 교수, 제3대 대한디지털치료학회장 선출
- [인사]노원을지대학교병원, 신임병원장에 김재훈 교수 선임
- [인사]보령 임원승진인사 단행…“전문성 중심 인재 중용”
- [인사]한림대성심병원, ‘두개안면·재건성형 명의’ 김경식 교수 초빙
- [인사]보건복지부 인사 발령 (12/19)
- [인사]을지재단 인사(1/1)
- [인사]SK바이오, 원액생산실장에 조봉준 부사장 선임
- [인사]삼성서울병원 설호준 교수, 대한두개저학회 차기 회장 선출
- [인사]한림대강남성심병원 이근영 교수, 국제주산의학회 이사 임명
- [동정]연세의대 이정윤 교수, 2026 제7회 난소암 컨센서스 컨퍼런스 공동의장 선임
- [동정]원주의과대학 이승현 연구원, 한국보건정보통계학회 학술대회 우수상
- [동정]경희대병원 유명철 교수, 대한안면신경학회 최우수상 수상
- [동정]고대 안산병원 박형준 교수, 아시아관절경학회 정기학술대회 우수 발표상 수상
- [동정]은평성모병원 최의윤 교수, 보건복지부 장관 표창
- [동정]고대 안산병원 한경화 수간호사, 응급 의료 발전 유공 안산시장 표창 수상
- [동정]서울성모병원 장기이식센터, 아태지역 최대 이식 학술대회 ‘ATW 2025’ 우수 초록상 연속 수상
- [동정]한림대의료원 서영균 빅데이터센터장, 보건복지부장관 표창
- [동정]녹십자, ‘LMO 안전관리 우수 기관’ 과기부 장관상 수상
- [동정]서울특별시 서남병원, 2025 공공보건의료 성과보고회에서 ‘보건복지부 장관상’ 수상












