[파트2] 미충족의료 해결로 블록버스터 등극할 신약은?
베타지중해성빈혈 치료제, 땅콩 알레르기 치료제 4년내 연매출 1조원대 달성 예상
- 양민후 기자 minhuy@medifonews.com
- 등록 2019-07-03 05:50:00
정보분석기업 ‘클래리베이트 애널리틱스’는 보고서를 통해 진보성을 기반으로 향후 4년 이내 연매출 1조원 달성이 예상되는 신약을 선정했다. 애브비의 '우파다시티닙(upadacitinib)'과 피브로젠∙아스텔라스∙아스트라제네카의 ‘Roxadustat’가 이름을 올렸다.
보고서는 미충족의료를 해결해 블록버스터로 등극할 가능성이 높은 신약들도 선발했다. 이 리스트에는 bluebird bio사의 Zynteglo(구 LentiGlobin)와
Aimmune Therapeutics사의 ‘AR-101’이
포함됐다.
◇ Zynteglo, 현존 치료법의 한계 극복…잠재적 블록버스터
Zynteglo는 베타지중해성빈혈(Beta-thalassemia; TDT)을 치료하는 유전자치료제다.
제약사측에 따르면 베타지중해성빈혈은 β-글로빈 유전자의 변이로 발생한다. 이런 변이는 적혈구 생성의 효율을 떨어뜨려 심각한 빈혈을 초래하는 것으로 알려졌다. 수혈
의존적 빈혈환자에게는 조혈모세포(HSC) 이식이 한 가지 대안으로 시행되고 있다. 다만 이런 치료법은 조직이 일치하는 형제∙자매 등 기증자가 존재하는 경우에만 가능하다.
Zynteglo는 환자의 자가 세포를 기반으로 만들어지는 치료제로
기증자가 부재한 상황을 해결한다. 환자의 세포를 채취해 정상 β-글로빈
생성이 가능하도록 가공한 뒤 다시 투여하는 과정으로 사용된다.
Zynteglo는 지난달 유럽에서 조건부 허가를 획득했다. 허가는 Northstar와 HGB-205
연구결과(단일군)를 바탕으로 이뤄졌다. 이 결과에 따르면, Zynteglo를 투여 받은 non-beta0/beta0 변이 환자 13명 중 12명은 정기적인 수혈 없이도 질환의 조절이 가능했다. 수혈 주기의
중간값은 27개월로 집계됐다.
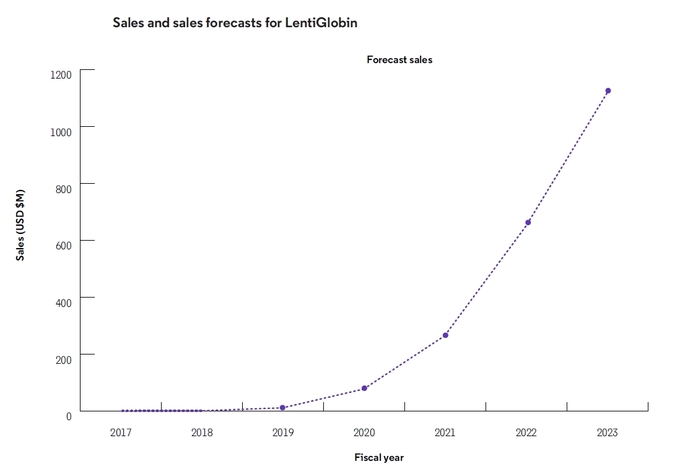
보고서는 Zynteglo가 미충족의료를 해결하며 시장에 안착할 것으로
내다봤다. 2019년 연매출은 1100만 달러(약 128억원)로 예측됐다. 2023년 이런 연매출은 11억 달러(1조3000억원)로 증가할 전망이다.
경쟁대상은 현존 치료법인 기증자를 통한 조혈모세포이식이다. 잠재적으로 Orchard Therapeutics사의 ‘OTL-300’와 CRISPR Therapeutics사의 ‘CTX-001’ 등 임상단계
유전자 치료제도 경쟁대열에 합류할 수 있다.
bluebird bio사는 올 하반기 미국에서 Zynteglo에 대한 허가를 신청할 계획이다.
◇ AR-101, 땅콩 알레르기 첫 대안…2023년 1조원대 연매출 예상
AR-101은 땅콩 알레르기를 치료하는 약물이다.
땅콩 알레르기 유병인구는 미국과 유럽 등에서 약 600만명에 이르는 것으로 조사됐다. 땅콩 알레르기는 다른 음식 관련 알레르기와는 달리 아낙필락시스 등을 유발해 생명을 위협하는 것으로 알려져 있다. 특히 이런 이상반응은 높은 확률로 평생 지속하는 것으로 나타났다. 현재 땅콩 알레르기 치료에 허가된 약은 전무하다. 에피네프린 주사제가 응급상황에 처방되는 수준이다.
AR-101은 땅콩 단백질을 함유한 경구복용제다. 땅콩에 대한 내성발달을 돕기 위해 고안됐으며 투여기간에 따라 용량을 늘리는 방식으로 사용된다.
제약사측은 지난해 12월 미국에서 AR-101에
대한 신약허가 신청서를 제출했다. 이 신청서에는 PALISADE 임상결과가
포함됐다. 이 연구에는 4~17세 땅콩 알레르기 환자들이
참여했다. 연구진은 참여자에 AR-101 또는 위약을 투여하며
땅콩 알레르기 내성발달 정도를 관찰했다.
그 결과, AR-101투여군의
67.2%는 땅콩 단백질 600㎎(땅콩
두 알 분량)까지 견뎠다. 반면 위약군은 4%만이 이런 용량을 수용할 수 있었다. 또 땅콩 단백질 1000㎎까지 견딘 비율은 AR-101군 50.3%, 위약군 2.4%였다. 이상반응의 정도 역시 AR-101군에서 더 낮았다. 이와 함께 AR-101은 RAMSES 연구에서 내약성도 입증했다.
현재 제약사측은 POSEIDON연구를 통해 AR-101의 효능을 1~3세 환자에 대해 평가하고 있다.
FDA는 올해 11월께
심사결과를 발표할 예정이다. 허가될 경우, AR-101은
최초의 음식 관련 알레르기 면역치료제로 기록된다.
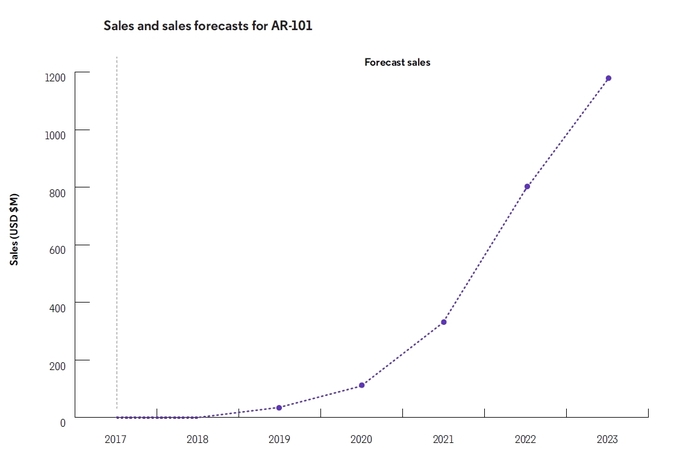
AR-101의 2019년
예상 매출액은 3500만 달러(약 408억원) 수준으로 예측된다. 이런
연매출액은 2023년 11억7000만 달러(1조3600억원)로 늘어날 것으로 보고서는 예상했다.
보고서는 AR-101이 경쟁 없이 시장에 진입할 것으로 봤다. 잠재적 경쟁제품의 시장진출이 늦어진 데 따른 판단이다. 경쟁사 DBV Technologies는 지난해 10월 땅콩 알레르기를 치료하는
‘Viaskin Peanut’(패치형)에 대한 허가신청서를 FDA에 제출했지만, 2개월 뒤 이런 결정을 철회했다. DBV Technologies는 올해 안으로 신청서를 다시 제출할 예정이다.
- [인사]전남대병원 김병채 교수, 대한치매학회 회장 선출
- [인사]한승범 고대 안암병원장, 상급종합병원협의회 신임회장 취임
- [인사]고신대복음병원, 최종순 교수를 신임 병원장으로 선임
- [인사]한국로슈, 에잣 아젬 대표이사 선임 (5/1)
- [인사]보건복지부 인사(5/1)
- [인사]조선대병원 임동훈 교수, 대한요로생식기감염학회 회장 선출
- [인사]보건복지부 인사(4/26)
- [인사]최광훈 회장, 건강기능식품이사에 이형우 약사 선임 (4/24)
- [인사]제약협회, 홍보전문위원장에 최천옥 한림제약 상무 재추대
- [인사]건일제약, 오인수 신임 마케팅본부장 영입
- [동정]중앙대병원 석준 교수, ‘글로벌 의사과학자 양성사업’ 선정
- [동정]현대약품, 대한산업안전협회 무재해 11배수 달성 인증패 수상
- [동정]셀트리온, 근로자 건강증진활동 우수사업장 선정
- [동정]환인제약, 제26회 환인정신의학상 시상
- [동정]전북대병원 이선영 교수팀, 국제학술지 ‘Cancers’ 에 논문 게재
- [동정]암젠, 아동·청소년 생명과학 교육 캠페인 서울시장 표창 수상
- [동정]칠곡경북대병원 성인 수두증 클리닉, 30억원 치매극복 기술개발 과제 수주
- [동정]갑상선 수술 관련 비디오 후두경 통한 기관삽관 유용성 입증
- [동정]한국머크 바이오파마, ‘일∙가정 양립 우수 기업’ 선정
- [동정]고대 구로병원 송준영 교수, 질병청·국립보건연구원 학술연구용역 과제 선정















