Pharma Focus
릴리 ‘버제니오’, 전이성·진행성 유방암 치료의 혁신
- 양민후 기자 minhuy@medifonews.com
- 등록 2019-07-17 14:31:19
전이성
유방암은 호르몬수용체(HR)와 인간 상피세포 성장인자수용체2(HER2)의
음성 혹은 양성 여부에 따라 총 4가지로 구분된다. 이 중 HR+/HER2-
유방암은 전체 전이성 유방암의 72%를 차지하고 있다.
전이성∙진행성 유방암은 뇌∙폐∙간 등 여러 장기로 전이되기 쉬워 완치가 어렵다. 전이성 유방암 환자의 5년 상대생존율은 38.9%에 그치고, 간 전이 환자는 생존기간 중앙값이 4.23개월에 불과하다.
그럼에도 불구하고 치료제의 진보는 정체돼 있었다. 지난 50여년간 HR+/HER2-를
포함한 전이성 유방암에는 여성 호르몬 생성을 억제하는 치료법이 사용됐다. 호르몬 치료제가
타목시펜에서 아로마타제 억제제로 변화한 수준에 머물렀다. 특히 타목시펜은 폐경, 혈전증, 자궁내막암을 동반하고 아로마타제 억제제는 관절통, 골다공증을 초래한다는 점에서 새로운 대안이 요구됐다.
그러다 미국종합암네트워크(NCCN) 가이드라인의 개정을 불러온 계기가
마련됐다. 바로 세포 분화∙성장에 관여하는 단백질인 사이클린
의존성 키나아제(CDK) 4/6을 억제하는 약물의 등장이다.
◇
버제니오, 폐경기 후 HR+/HER2- 전이성∙진행성 유방암의 새로운 대안
릴리의 버제니오(성분명:아베마시클립)는 CDK 4/6을 선별적으로 억제해 암세포 증식을 막는 차세대 표적
치료제다. 다른 CDK 4/6 억제제 대비 중증 호중구
감소증 발현 빈도가 비교적 낮다는 장점이 있다. 휴약기간이 없고 식사와 무관하게 복용할 수 있다는 특징도
가지고 있다.
버제니오는 2018년 2월
미국에서 아로마타제 억제제와의 콤보가 폐경기 후 HR+/HER2- 전이성∙진행성 유방암 1차 내분비 기반요법에 허가됐다.
국내에서는 2019년 5월 승인됐다.
◇ 버제니오·아로마타제억제제 ,Monarch-3서 PFS 2배로 향상
허가는 Monarch-3(3상∙이중맹검∙위약대조)결과를 바탕으로 한다. 이
연구에서는 버제니오와 아로마타제 억제제(아나스트로졸 또는 레트로졸) 콤보의
효능이 평가됐다.
Monarch-3에는 치료 경험이 없는 폐경기 후 HR+/HER2- 전이성∙진행성 유방암 환자 493명이 참여했다. 연구진은 참여자에게 아베마시클립∙아로마타제 억제제 콤보 또는 위약∙아로마타제 억제제(이하 단독군)를
투여하며 경과를 지켜봤다. 1차유효성평가변수로는 무진행생존기간(PFS),
2차유효성평가변수로는 객관적 반응률(ORR)과 반응지속기간(DoR) 등이 측정됐다.
그 결과, PFS 중앙값은 아베마시클립 콤보군 28.2개월, 단독군 14.76개월이었다. 위험비(HR)는 0.5로
집계됐다.
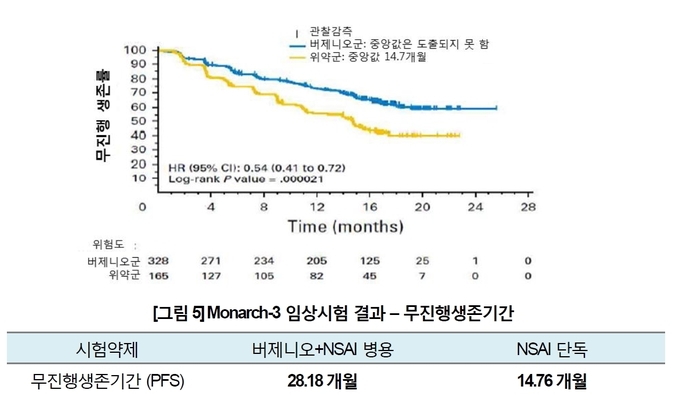
ORR은 버제니오 콤보군 48.2%로 단독군(34.5%)보다 높았다.
◇ MONARCH2서 버제니오·풀베스트란트 콤보 효능 입증
버제니오는 2017년 미국에서 풀베스트란트와의 병용요법이 내분비 요법 후 질병이 진행된 HR+/HER2- 전이성∙진행성 유방암 치료에 허가됐다.
허가는 MONARCH2 연구결과를 기반으로 한다. 주요결과를 살펴보면, PFS 중앙값(1차유효성평가변수)은 버제니오 투여군에서 16.4개월, 위약 투여군에서 9.3개월이었다(위험비: 0.553, 95% 신뢰구간: 0.449-0.681, P <0.001).
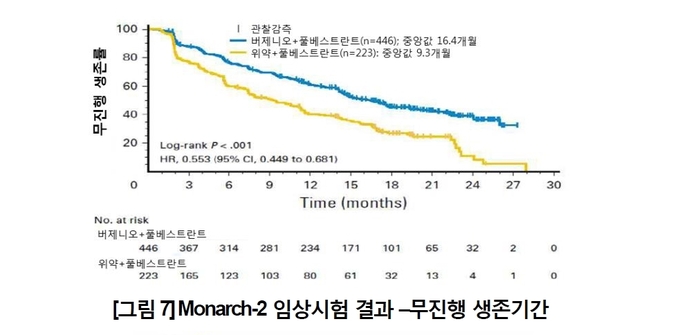
2차 유효성평가변수로 측정된 ORR은 버제니오군 35.2%, 위약군 16.1%였다.
연구에서 보고된 주요 부작용은 설사, 호중구 감소증, 오심, 피로, 복통이었다.
NCCN 가이드라인은 이런 CDK 4/6 억제제의 효능을 높이 평가했다. 폐경기 후 HR+/HER2- 전이성∙진행성 유방암 치료에 CDK 4/6억제제와 아로마타제 억제제(또는 풀베스트란트) 병용요법을 카테고리1에 올렸다.

- [동정]고려대의료원 윤주성 팀장, 대한병원정보협회장 연임
- [부음]이승우 의협신문 기자 별세
- [동정]일산백병원 최준영 교수, ‘상병수당 제도 발전 기여’ 국민건강보험공단 이사장 표창
- [동정]아주대학교병원 교수 7명, 대한민국의학한림원 정회원 및 공헌회원 선출
- [동정]화순전남대병원 김미현 임상병리사, 임상병리사협회장상 수상
- [인사]명지병원, ‘뇌졸중 전문가’ 최영빈 교수 영입
- [인사]동산의료원·동산병원·대구동산병원 보직인사(2/1)
- [인사]삼성서울병원, 원장단 및 주요 보직 인사(2/1)
- [동정]대한의학회 의학공헌상·윤광열 의학상 수상자 선정
- [인사]배재훈 교수, 계명대학교 동산의료원장 취임
- [인사]명지병원, ‘뇌졸중 전문가’ 최영빈 교수 영입
- [인사]동산의료원·동산병원·대구동산병원 보직인사(2/1)
- [인사]삼성서울병원, 원장단 및 주요 보직 인사(2/1)
- [인사]배재훈 교수, 계명대학교 동산의료원장 취임
- [인사]동화약품, 장재원 연구개발본부장 선임
- [인사]HLB 자회사 엘레바, 김동건 대표 선임
- [인사]서울대병원 우홍균 교수, 아시아방사선종양학회연합회 회장 취임
- [인사]서울대병원 박중신 교수, 제26대 대한의학회 회장 선출
- [인사]대전성모병원 이상권 교수, 대한비만학회 부회장 선출
- [인사]고대 안암병원 민재석 교수, 대한위장관외과학회 대한위장관항암연구회 회장 취임
- [동정]고려대의료원 윤주성 팀장, 대한병원정보협회장 연임
- [동정]일산백병원 최준영 교수, ‘상병수당 제도 발전 기여’ 국민건강보험공단 이사장 표창
- [동정]아주대학교병원 교수 7명, 대한민국의학한림원 정회원 및 공헌회원 선출
- [동정]화순전남대병원 김미현 임상병리사, 임상병리사협회장상 수상
- [동정]대한의학회 의학공헌상·윤광열 의학상 수상자 선정
- [동정]한림대춘천성심병원 박찬흠 교수, 우주항공청 ‘차세대중형위성 3호 개발 기여자 유공’ 표창
- [동정]대구가톨릭대학교병원 조명래 교수, 제16회 ‘윤광열 의학상’ 수상
- [동정]서울성모병원 신희종 교수, EGA 학회 최우수 학술상 수상
- [동정]고대 구로병원 남가은 교수, ‘서울특별시의회 의장 표창’ 수상
- [동정]현대약품, 무재해 12배수 달성…대한산업안전협회 인증패 수상













