코오롱생명과학, 통증 치료 ‘KLS-2031’ 미국 임상 개시
글로벌 파트너사와 밀접한 커뮤니케이션으로 해외 진출의 다양한 방향 모색할 것
- 강찬구 기자 kcg@medifonews.com
- 등록 2020-02-25 11:10:19
 코오롱생명과학은 2019년 3월 미국식품의약국(FDA)에서 IND(임상시험 계획 승인, Investigational New Drug) 승인된 신경병증성 통증 치료제 신약(KLS-2031)의 미국임상 1상/2a상 개시와 패스트트랙 지정을 받았다고 24일 밝혔다.
코오롱생명과학은 2019년 3월 미국식품의약국(FDA)에서 IND(임상시험 계획 승인, Investigational New Drug) 승인된 신경병증성 통증 치료제 신약(KLS-2031)의 미국임상 1상/2a상 개시와 패스트트랙 지정을 받았다고 24일 밝혔다.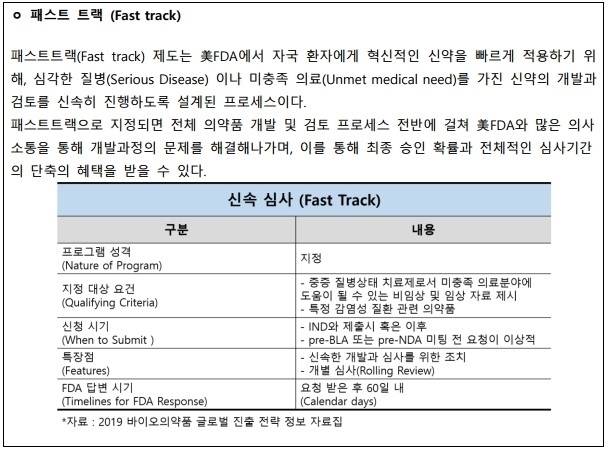
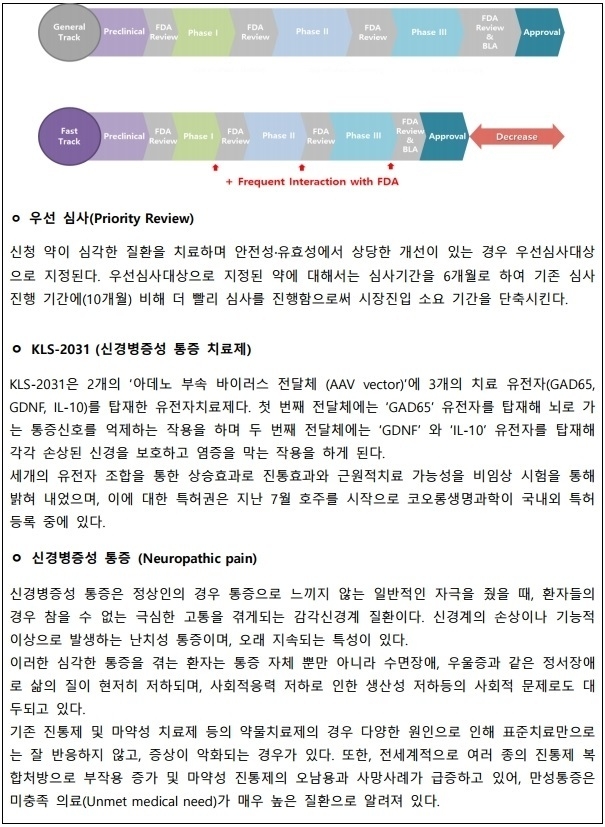
KLS-2031은 신경병증성 질환 중 요천골 신경근병증 통증에 대한 First-in-class 신약 후보물질로 기존 신경병증성 통증 치료 방식과 달리 특허 받은 유전자 조합을 이용한 주사 요법의 치료제이며 1회 국소 주사 시술방식으로 진통 효능이 장기간 지속되고 근원적 치료가 가능하도록 개발됐다.
신약은 2019년 12월 미국 내 임상기관의 IRB 첫 승인을 마쳤으며 2020년 3월경 첫 환자 방문을 시작으로 미국 내 2개의 임상 기관과 안전성 및 유효성 평가를 목적으로 임상 1상/2a상을 진행할 예정이다. 임상 1상/2a상의 대상자는 총 18명으로 투약 후 24개월간 추적 관찰하고 이를 통해 이후 임상 단계 진행 방향을 결정하게 된다.
또한 FDA와 개발기간 중 신속한 사전협의와 각 임상단계별 동반 심사(Rolling review)등을 통해 심사기간 단축 및 최종 승인 확률을 높일 수 있으며 임상 3상 이후 신청 가능한 우선 심사(Priority review)를 통해 심사기간을 단축 할 수 있다.
회사 측은 “신약은 기존 시판된 치료제로는 효과를 보지 못한 신경병증성 통증 환자들을 타겟으로 삼았으며 최근 6년간 패스트트랙 지정 신약 중 우선심사가 된 확률은 90% 이상이다”라며 “생명공학정책연구센터의 자료에 따르면 FDA의 최근 3년간 153개 신약 승인 중 39%가 패스트트랙 지정, 65%가 우선심사를 거치는 등 개발기간 단축과 임상 2,3상의 성공적인 설계 및 검토도 가능할 것으로 본다”라고 설명했다.
코오롱생명과학 관계자는 “향후 KLS-2031은 요천골 신경근병증 뿐만 아니라 다른 신경병증성 통증질환에도 확장성을 가질 수 있는 신약으로 개발될 것이다”라며 “앞으로 커져가는 통증 치료 분야에서 근원적 치료제를 만들기 위해 글로벌 파트너사와 밀접한 커뮤니케이션으로 해외 진출의 다양한 방향을 모색할 계획이다“라고 말했다.
한편 전세계적으로 통증관련 시장은 2016년 23조원 규모에서 2023년 34조원 가량의 규모로 연평균 5% 이상 성장할 것으로 예측됐으며 KLS-2031가 관련된 신경병증성 통증 시장은 2022년 4조원에 달하는 규모가 될 것으로 예상된다.
- [동정]휴온스그룹 3社, 무역의 날 ‘수출의 탑’ 수상
- [동정]GC녹십자엠에스, ‘500만불 수출의 탑’ 수상
- [동정]서울대어린이병원 소아청소년당뇨병교실, 국회의장 공로상 수상
- [동정]한미사이언스-한미약품, 지역사회공헌 인정…복지부 장관 표창
- [인사]보건복지부 인사 발령 (12/8)
- [동정]고대 안암병원 박영빈 교수, 아시아-오세아니아 임상신경생리학회 우수 포스터상 수상
- [동정]아주대병원 이장훈 교수, 보건복지부장관 표창 수상
- [동정]고대 안산병원 감염관리실 박은혜 대리, 감염병관리시설 운영관리 유공 질병청장 표창 수상
- [동정]영남대병원 성형외과 연구팀, 대한두경부종양학회 추계학술대회 우수포스터상 수상
- [동정]한국애브비 허가등록부 신미현 이사, 식약처장 표창 수상
- [인사]보건복지부 인사 발령 (12/8)
- [인사]SK케미칼·SK플라즈마, 2026년도 임원인사 발표
- [인사]질병관리청 공무원 인사발령
- [인사]SK바이오사이언스 2026년 임원인사 (12/10)
- [인사]광동제약, 박상영 사장 대표이사 신규 선임
- [인사]이대목동병원 최희정 교수, 제33대 대한감염학회 회장 취임
- [인사]전남대병원 정신 교수, 대한뇌신경기능장애연구회 신임 회장 취임
- [인사]국립암센터 박현진 교수, 대한소아혈액종양학회 이사장 취임
- [인사]녹십자홀딩스, 박소영 전략기획실장 영입
- [인사]GC 계열사 정기임원인사 단행 (1/1)
- [동정]휴온스그룹 3社, 무역의 날 ‘수출의 탑’ 수상
- [동정]GC녹십자엠에스, ‘500만불 수출의 탑’ 수상
- [동정]서울대어린이병원 소아청소년당뇨병교실, 국회의장 공로상 수상
- [동정]한미사이언스-한미약품, 지역사회공헌 인정…복지부 장관 표창
- [동정]고대 안암병원 박영빈 교수, 아시아-오세아니아 임상신경생리학회 우수 포스터상 수상
- [동정]아주대병원 이장훈 교수, 보건복지부장관 표창 수상
- [동정]고대 안산병원 감염관리실 박은혜 대리, 감염병관리시설 운영관리 유공 질병청장 표창 수상
- [동정]영남대병원 성형외과 연구팀, 대한두경부종양학회 추계학술대회 우수포스터상 수상
- [동정]한국애브비 허가등록부 신미현 이사, 식약처장 표창 수상
- [동정]레이저옵텍 주홍 회장 ‘2025 참 좋은 중소기업·소상공인 대상’ 수상














