"EMA 허가 항암제의 대다수, 약효 평가 기반 빈약"
영국 연구팀, 32개 항암제 허가 임상 분석결과 BMJ에 소개
- 양민후 기자 minhuy@medifonews.com
- 등록 2019-10-14 05:50:00
근래 등장한 항암제들은 효능이 얼마나 검증됐을까. 무작위배정연구(RCT)를 바탕으로 허가된 비율은 많았지만, 근거 수준이 모두 높지는 않았다. RCT의 대다수는 전체생존기간(OS) 대신 무진행생존기간(PFS) 등 대리지표를 통해 약효가 측정된 것으로 나타났다. 또 연구의
영국 런던정치경제대 Huseyin Naci 교수팀은 최근 이 같은 내용의
연구결과를 BMJ에 게재했다.
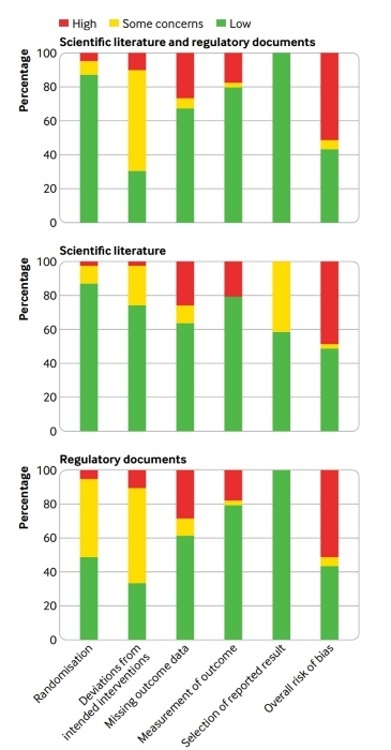
연구팀은 최근 상용화된 항암제들이 효능에 대한 적절한 평가가 이뤄졌는지 살펴보기로 했다. 지난 2014년부터 2016년까지 유럽의약품청(EMA)의 허가를 받은 항암제 32개 제품을 연구대상으로 선정했다.
분석에 따르면, 이들 제품은 총 54개의 결정적 연구를 통해 승인됐다. 이 가운데 41개(76%)는 RCT 기반이었고, 나머지는 단일군 연구였다.
RCT 중 OS를 1차평가변수로 측정한 연구는 10개(26%)에 그쳤다. 나머지 연구에서는 PFS나 반응률(OS) 등 대리지표가 평가된 것으로 나타났다.
특히 RCT의 49%(19개)는 비뚤림의 위험이 높았다. 구체적으로 데이터 부재(10개) 또는 결과 측정법(7개) 등으로 인해 비뚤림의 위험이 감지됐다. BMS·애브비의 Empliciti(성분명:elotuzumab), GSK의 Mekinist(trametinib),
그리고 BMS·오노약품공업의 Opdivo(nivolumab) 등이 여기에 해당했다.
Empliciti는 결정적 연구 중 하나(CA204-009)를 개방형으로 진행했다. 맹검이 적용되지 않아 비뚤림의 위험이 큰 것으로 확인됐다. Opdivo는 CA209-037에서 주요 데이터가 부재했다. 이런 부재는 진정한 약효 평가에 영향을 미칠 수 있다고 분석됐다. Mekinist는 BRF113220 연구에서 중도절단(censoring) 관련 이슈가 존재했다. 중도절단 비율은 대조약(dabrafenib) 투여군 31%, Mekinist 투여군 11%로 균형이 맞지 않았다.
연구팀은 OS를 측정한 RCT는 비뚤림의 위험이 덜하다는 사실도 확인했다. 세부적으로 비뚤림 위험 비율은 OS 측정 RCT 20%, OS 비측정 RCT 55%였다.
EMA는 이 기간 허가한 일부 약물의 효능 등에 의문을 제기하기도 했다. 하지만 학술 문헌에서는 이런 지적에 대한 '연구의 제한점' 등이 명확히 표시되지 않은 경우가 다수 존재했다.
일례로 Ninlaro(성분명: ixazomib, 제약사: 다케다)는 임상적 유효성에 의문이 제기됐다. 최초 제출한 결과와 업데이트된 결과를 통해 약효의 감소가 관찰됐기 때문이다. 이에 대해 EMA는 의견이 분분했지만 결국 조건부 허가라는 결정을 내렸다. 다만 학술 문헌은 최초 제시한 연구결과만을 명시하고 있었다고 연구팀은 지적했다.
Cyramza(ramucirumab, 릴리)의 경우 REGARD연구에서 성별에 따라 효능의 차이가 있었다. 하지만 학술 논문은 "Cyramza의 효능은 하위그룹에 걸쳐 일관성 있었다"며 "비록 Cyramza는 여성에서 OS 지표가 다소 감소했지만, PFS에서 우호적인 결과를 이끌었다"고 안내하고 있었다.
이 밖에도 Lynparza(olaparib, 아스트라제네카), Opdivo(nivolumab, BMS), Farydak(panobinostat, 노바티스), Cotellic(cobimetinib, 제넨테크), Imlygic(talimogene, 암젠), Darzalex(daratumumab, 얀센), Zydelig(idelalisib, 길리어드)가 대조군의 적절성 및 임상적 유효성 등에서 의문 부호를 달았지만, 학술 문헌에서는 이에 관한 해명을 찾을 수 없었다.
연구팀은 논문에서 “2014년부터 2016년까지 EMA 허가를 획득한 항암제들은 대부분 RCT를 기반으로 효능이 평가됐다”며 “다만, RCT의 절반가량은 비뚤림의 위험이 높은 것으로 확인됐다”고 평가했다.
이어 “이런 비뚤림은 항암제 연구의 복잡성으로 인해 불가피하게 발생했을
가능성도 존재한다”며 “특히 학술 문헌은 연구가 가진 여러 제한점을 명확히 표시하지 않고 있다는 사실도 확인할 수 있었다”고 덧붙였다.
- [동정]건양대병원 김광균 교수, 대한노년근골격의학회 최우수구연상
- [동정]동아제약, 제5회 대한민국 착한기부대상 ‘국무총리 표창’ 수상
- [동정]한올바이오파마, 산업기술국제협력 유공자 포상 산업통상부 장관 표창 수상
- [동정]제뉴원사이언스, 제62회 무역의 날 ‘1000만불 수출의 탑’ 수상
- [동정]HK이노엔, 한국ESG기준원 ESG평가서 2년 연속 ‘우수기업’ 수상
- [동정]고대구로병원 김현구, 김진원 교수, 보건의료기술진흥 유공자 정부포상 ‘보건복지부장관 표창’ 수상
- [동정]한림대동탄성심병원, ‘스마트 의료지도 시범사업’ 우수기관 장관상 수상
- [동정]세란병원 김지연 센터장, 척추내시경수술 국제 교과서 편집장 참여
- [동정]국립암센터국제암대학원대학교 Trang Thu La·장준하 대학원생, 대한암예방학회 우수포스터상 수상
- [동정]유경하 이화의료원장, 테디스 어워즈 2025 ‘희망과 감동상’ 수상
- [인사]이대목동병원 정경아 교수, 대한산부인과 로봇수술학회 회장 취임
- [인사]보건복지부 인사 발령 (12/8)
- [인사]SK케미칼·SK플라즈마, 2026년도 임원인사 발표
- [인사]질병관리청 공무원 인사발령
- [인사]SK바이오사이언스 2026년 임원인사 (12/10)
- [인사]광동제약, 박상영 사장 대표이사 신규 선임
- [인사]이대목동병원 최희정 교수, 제33대 대한감염학회 회장 취임
- [인사]전남대병원 정신 교수, 대한뇌신경기능장애연구회 신임 회장 취임
- [인사]국립암센터 박현진 교수, 대한소아혈액종양학회 이사장 취임
- [인사]녹십자홀딩스, 박소영 전략기획실장 영입
- [동정]건양대병원 김광균 교수, 대한노년근골격의학회 최우수구연상
- [동정]동아제약, 제5회 대한민국 착한기부대상 ‘국무총리 표창’ 수상
- [동정]한올바이오파마, 산업기술국제협력 유공자 포상 산업통상부 장관 표창 수상
- [동정]제뉴원사이언스, 제62회 무역의 날 ‘1000만불 수출의 탑’ 수상
- [동정]HK이노엔, 한국ESG기준원 ESG평가서 2년 연속 ‘우수기업’ 수상
- [동정]고대구로병원 김현구, 김진원 교수, 보건의료기술진흥 유공자 정부포상 ‘보건복지부장관 표창’ 수상
- [동정]한림대동탄성심병원, ‘스마트 의료지도 시범사업’ 우수기관 장관상 수상
- [동정]세란병원 김지연 센터장, 척추내시경수술 국제 교과서 편집장 참여
- [동정]국립암센터국제암대학원대학교 Trang Thu La·장준하 대학원생, 대한암예방학회 우수포스터상 수상
- [동정]유경하 이화의료원장, 테디스 어워즈 2025 ‘희망과 감동상’ 수상














