[제약·의료기계 소식통]덱스콤 연속당측정기 'G5’ 식약처 허가 획득
하루 수번 채혈해야 하는 소아당뇨 환자의 삶의 질에 큰 개선 기대
- 김윤미 기자 kym@medifonews.com
- 등록 2018-10-01 13:01:24
미국 덱스콤의 연속당측정기인 'G5'가 식약처 품목허가를 획득하여 국내 출시를 앞두고 있어, 하루 수번 채혈해야 하는 소아당뇨 환자의 기존 불편함이 크게 개선될 것으로 기대되고 있다. / 한국로슈진단의 'P1NP 테스트'가 10월 1일부로 골다공증 약물치료 전후 골흡수표지자검사와 골형성표지자검사에 건강보험급여를 적용 받았다. / 보스톤사이언티픽코리아의 약물방출 말초혈관 스텐트 '일루비아'가 head-to-head 임상인 IMPERIAL 연구 결과를 발표하며, PAD 환자에서 대조군 대비 유의미한 치료효과 개선과 재시술 감소 효용성을 입증했다. / 종근당이 최근 ‘2018 세계고혈압학회’에서 고혈압 치료제 ‘텔미누보’의 리얼월드 연구결과를 발표하며, 실제 진료현장에서 우수한 혈압강하 효과와 안전성을 입증했다. / 큐리언트가 개발 중인 다제내성결핵치료제 ‘텔라세벡’가 범부처신약개발사업단 지원과제로 3번 연속 선정되는 쾌거를 이뤘다.
메디포뉴스가 1일자 제약·의료기기 업계의 주요 뉴스를 모아봤다.
덱스콤의 연속당측정기 'G5', 식약처 허가 획득으로 10월 중 발매
미국 덱스콤(Dexcom, Inc.)의 연속당측정기(Continuous Glucose Monitoring, CGM)인 'Dexcom G5 Mobile Continuous Glucose Monitoring System (이하 G5)'가 식품의약품안전처로부터 품목허가를 획득하여 국내 출시를 앞두고 있다고, 국내 공식 수입사인 사이넥스가 1일 발표했다.
'G5'는 센서가 피부 바로 밑에 이식되어 연속적으로 당(글루코오스)을 측정하고, 측정된 값을 5분 간격으로 스마트폰 어플리케이션 또는 웨어러블 디바이스에 전송해 확인할 수 있는 연속당측정기다.
'G5' 모바일 어플리케이션을 통해 최대 5명까지 데이터를 전송 받을 수 있으며 환자 맞춤 설정을 통해 고혈당 및 저혈당 시 즉시 경고 알림이 작동함으로써 1형 및 2형 당뇨 환자의 건강 상태를 가족들이 밀착 관리할 수 있다.
또한, 채혈의 횟수를 1일 2회로 줄여, 특히 혈당 측정을 위해 하루에 여러 번 채혈을 해야 하는 소아당뇨 환자들은 기존의 불편함이 크게 개선될 전망이다.
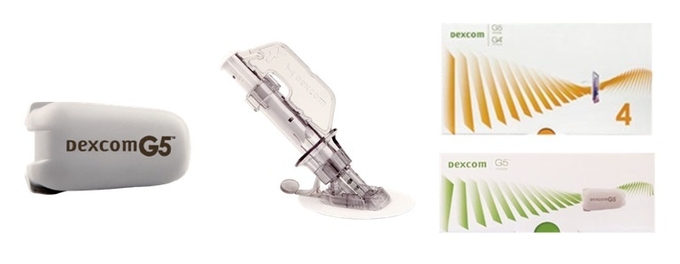
덱스콤 연속당(글루코오스)측정기 'G5'는 ▲피부 바로 밑에 이식되어 연속적으로 당을 측정하는 소형 센서와 ▲블루투스 기술을 이용해 당 측정 데이터를 송신하는 송신기(트렌스미터), 그리고 ▲Dexcom G5 Mobile 어플리케이션과 호환되는 Android 스마트 장치로서 당의 최고, 최저 또는 적정 수치 파악 가능한 모바일 어플리케이션으로 구성되어 있다.
G5의 국내 공식 수입사인 사이넥스의 정혜경 본부장은 “덱스콤사의 연속당측정기 G5는 10월 중으로 국내에서 정식 발매될 예정이며, 사이넥스는 G5의 국내 공식 수입사로서 원활한 국내 공급을 약속한다”고 각오를 다졌다.
한국로슈진단, 골표지자 혈액검사 ‘P1NP 테스트’ 보험 급여 적용
한국로슈진단은 폐경기 여성의 골다공증과 페제트병의 약물치료 모니터링에 유용한 'P1NP 테스트'가 10월 1일부로 건강보험급여 적용을 받게 됐다고 발표했다.
 급여 적용 대상은 ▲골다공증 약물치료 시작 전 1회, ▲골다공증 약물치료 3~6개월 후 약제 효과 판정을 위해 실시 시 1회 가능하며, 골흡수표지자검사와 골형성표지자검사를 각각 1종씩 인정한다.
급여 적용 대상은 ▲골다공증 약물치료 시작 전 1회, ▲골다공증 약물치료 3~6개월 후 약제 효과 판정을 위해 실시 시 1회 가능하며, 골흡수표지자검사와 골형성표지자검사를 각각 1종씩 인정한다.
'P1NP 검사'는 혈청 및 혈장에서 총 P1NP (total procollagen type 1 amino-terminal propeptide)를 측정하는 검사로, P1NP는 골흡수억제제 사용시 급격히 감소하며 골형성촉진제 사용시 급격히 증가한다.
이번에 급여 대상으로 지정된 P1NP 테스트는 폐경기 여성 골다공증 환자와 페제트병(Paget’s disease) 환자들을 대상으로 골다공증 약제치료 반응을 모니터링하는 전 자동화된 검사로 검사자로 인한 편차가 없다는 것이 장점이다.
기존에 골다공증 치료 모니터링으로 사용한 골밀도측정검사(BMD)의 경우에는 연 1회 보험청구가 가능한 반면, P1NP 골표지자 검사는 이번 보험급여 덕분에 약물치료 시작 전과 약물치료 3~6개월 후 사용할 수 있게 되었다.
한국로슈진단 리처드 유 대표이사는 “P1NP 검사의 보험 적용으로 보다 많은 폐경기 여성 골다공증 환자와 페제트병 환자들이 합리적인 가격으로 약제에 대한 모니터링을 할 수 있게 되어서 기쁘게 생각한다"며, "의료진에게도 P1NP 골표지자 검사가 약물치료 결정부터 치료 중단, 치료 방법 변경, 치료 지속 등을 결정하는 데에 도움이 되길 바란다”고 말했다.
보스톤사이언티픽 ‘일루비아’, 주요 학회서 질버PTX와 직접 비교한 IMPERIAL 연구 결과 발표
보스톤사이언티픽코리아는 지난 22일 표재성 대퇴동맥(SFA) 치료 분야 최초로 약물방출 말초혈관 스텐트 간 직접 비교(head-to-head) 연구인 IMPERIAL 임상연구의 12개월 진행 결과를 발표했다.
이번 연구결과는 샌디에고에서 개최된 제30회 미국관상동맥중재술학회(Transcatheter Cardiovascular Therapeutics, TCT)의 심혈관연구재단 연례 학술 심포지엄과 포르투갈 리스본에서 개최된 유럽심혈관·인터벤션영상의학회(Cardiovascularand Interventional Radiological Society of Europe, CIRSE) 연례 회의에서 동시 발표됐으며, 임상 연구 결과는 의학 전문지 '란셋(The Lancet)'을 통해서도 게재된다.
IMPERIAL 임상연구는 증후성 말초동맥질환(PAD) 환자를 대상으로 '일루비아'와 '질버PTX'의 임상적 효과를 직접 비교해 평가한 head-to-head 방식으로 진행됐다.
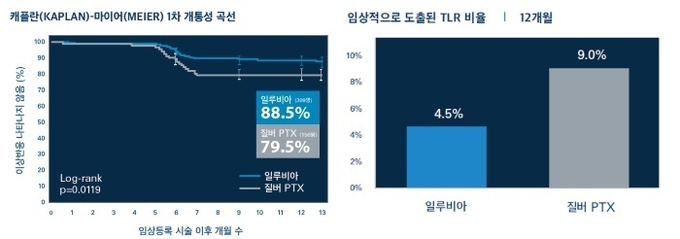
연구 결과, 일루비아 스텐트로 치료받은 환자군은 혈관의 1차 개통성 비율이 88.5%로 질버 PTX 치료 환자군 79.5% 대비 통계적으로 유의성 있는 차이를 보였다. 표적 병변 혈관재개통술(TLR) 비율도 일루비아 치료 환자군에서 4.5%로 질버 PTX 환자군 9.0% 대비 절반정도 낮게 나타났다.
또한, 일루비아 치료 환자군의 95% 이상이 1년 평가시점에서 주요 이상반응을 보이지 않았으나, 질버 PTX 환자군에서는 91.0% 가 주요 이상반응을 보이지 않았다.
IMPERIAL 임상의 공동 책임연구를 맡은 윌리엄 그레이(William Gray) 펜실베니아 란케노 심장연구소(Lankenau Heart Institute) 심혈관질환 부문 원장은 “IMPERIAL 임상연구 결과는 매우 인상적이며, 해당 결과는 파클리탁셀이 혈관 내 지속적으로 방출되는 일루비아만의 고유 기술을 통해 수개월 후에 발생하는 혈관(SFA)의 재협착 시기까지 약물 방출이 유지될 수 있었기 때문"이라고 설명하며, "이로 인해 반복적인 시술의 필요성을 줄일 수 있음을 보여주었다”고 설명했다.
종근당, 2018 세계고혈압학회서 ‘텔미누보’ 임상결과 발표
 종근당이 최근 중국 베이징에서 개최된 ‘2018 세계고혈압학술대회(International Society of Hypertension)’에서 자사의 고혈압 치료제 ‘텔미누보’의 임상 결과를 발표했다.
종근당이 최근 중국 베이징에서 개최된 ‘2018 세계고혈압학술대회(International Society of Hypertension)’에서 자사의 고혈압 치료제 ‘텔미누보’의 임상 결과를 발표했다.
해당 연구은 2013년 텔미누보 출시 후 국내 개원가 전문의들이 4년간 진료 현장에서 '텔미누보'를 복용한 고혈압 환자 3만 2,061명의 혈압강하 효과와 이상반응을 관찰한 리얼월드 데이터 분석 연구이다.
연구 결과에 따르면, 텔미누보를 투여한 환자 중 목표 혈압인 수축기 140 미만, 이완기 90 미만에 도달한 환자 수는 2만 2,090명으로 전체 환자의 74%에 달해 혈압강하 효과 평가에서 유의한 결과를 나타났다.
이상반응 발생 건수는 전체 환자의 1.7%인 545건으로 발생 비율이 낮았으며, 암로디핀 복합제에서 빈번하게 나타나는 발목 부종은 4건으로 전체 환자의 0.0001%에 불과했다. 특히 환자의 약 18%가 10년 이상 고혈압 치료제를 복용한 고위험 환자임에도 이상반응 발생건수는 낮아 약물 장기복용 환자에게도 안전성이 우수한 것으로 확인됐다.
종근당 관계자는 “이번에 발표한 임상결과는 대규모의 국내 환자를 대상으로 진행됐으며 장기간 실제 진료현장에서 우수한 혈압강하 효과와 안전성을 입증한 결과여서 더욱 의미가 크다”며 “텔미누보가 고혈압 환자들과의료진에게 더욱 신뢰할 수 있는 제품으로 자리매김할 것으로 기대한다"고 말했다.
큐리언트 다제내성결핵치료제 ‘텔라세벡’, 범부처신약개발사업단 과제 선정
 큐리언트는 글로벌 초기 임상 2상 진행 중인 다제내성결핵치료제 ‘텔라세벡’이 범부처신약개발사업단 지원과제로 선정되어 연구 협약을 체결했다고 발표했다.
큐리언트는 글로벌 초기 임상 2상 진행 중인 다제내성결핵치료제 ‘텔라세벡’이 범부처신약개발사업단 지원과제로 선정되어 연구 협약을 체결했다고 발표했다.
큐리언트는 사업단과의 연구협약을 통해 ‘다제내성/광범위내성 결핵 치료 혁신신약 후보물질 Q203의 임상 2상 개발’을 진행할 예정이며, 이 과제는 비임상, 임상 1상에 이어 세 번 연속 사업단의 지원을 받게 되었다.
큐리언트는 다제내성결핵뿐만 아니라 광범위내성, 완전내성에서의 치료효능도 기대되는 ‘텔라세벡’을 개발 중이며 지난 7월 미 FDA와 남아공 식약처 승인 하에 초기 임상 2상에 착수하였다.
결핵 환자 54명을 대상으로 진행될 계획이며, 임상 1상에서 안전성이 확보된 3가지 용량이 각각 투여된다. 우수한 비임상 및 임상 1상 결과에 따라 이번 초기 임상 2상의 경우 결핵 치료제 임상분야의 세계적 권위자인 안드레아스 디아콘 박사와 로드니 도슨 박사가 주도하고 있다.
큐리언트 관계자는 “이번 사업단과의 연구협약은 텔라세벡의 우수성과 성공 가능성을 외부 전문가로부터 다시 한번 확인한 것이며 사업단의 지원에 힘입어 더욱 더 속도감 있는 임상을 진행하게 되었다”라며, ‘텔라세벡’ 성공에 대한 기대감을 보였다.
- [동정]연세의대 이정윤 교수, 2026 제7회 난소암 컨센서스 컨퍼런스 공동의장 선임
- [동정]원주의과대학 이승현 연구원, 한국보건정보통계학회 학술대회 우수상
- [동정]경희대병원 유명철 교수, 대한안면신경학회 최우수상 수상
- [동정]고대 안산병원 박형준 교수, 아시아관절경학회 정기학술대회 우수 발표상 수상
- [인사]휴온스그룹, 2026년 정기 임원 인사 실시 (1/1)
- [동정]은평성모병원 최의윤 교수, 보건복지부 장관 표창
- [동정]고대 안산병원 한경화 수간호사, 응급 의료 발전 유공 안산시장 표창 수상
- [동정]서울성모병원 장기이식센터, 아태지역 최대 이식 학술대회 ‘ATW 2025’ 우수 초록상 연속 수상
- [부음]강재수 일암의료재단 삼례고려병원 이사장 별세
- [인사]고대 안암병원 이헌정 교수, 제3대 대한디지털치료학회장 선출
- [인사]휴온스그룹, 2026년 정기 임원 인사 실시 (1/1)
- [인사]고대 안암병원 이헌정 교수, 제3대 대한디지털치료학회장 선출
- [인사]노원을지대학교병원, 신임병원장에 김재훈 교수 선임
- [인사]보령 임원승진인사 단행…“전문성 중심 인재 중용”
- [인사]한림대성심병원, ‘두개안면·재건성형 명의’ 김경식 교수 초빙
- [인사]보건복지부 인사 발령 (12/19)
- [인사]을지재단 인사(1/1)
- [인사]SK바이오, 원액생산실장에 조봉준 부사장 선임
- [인사]삼성서울병원 설호준 교수, 대한두개저학회 차기 회장 선출
- [인사]한림대강남성심병원 이근영 교수, 국제주산의학회 이사 임명
- [동정]연세의대 이정윤 교수, 2026 제7회 난소암 컨센서스 컨퍼런스 공동의장 선임
- [동정]원주의과대학 이승현 연구원, 한국보건정보통계학회 학술대회 우수상
- [동정]경희대병원 유명철 교수, 대한안면신경학회 최우수상 수상
- [동정]고대 안산병원 박형준 교수, 아시아관절경학회 정기학술대회 우수 발표상 수상
- [동정]은평성모병원 최의윤 교수, 보건복지부 장관 표창
- [동정]고대 안산병원 한경화 수간호사, 응급 의료 발전 유공 안산시장 표창 수상
- [동정]서울성모병원 장기이식센터, 아태지역 최대 이식 학술대회 ‘ATW 2025’ 우수 초록상 연속 수상
- [동정]한림대의료원 서영균 빅데이터센터장, 보건복지부장관 표창
- [동정]녹십자, ‘LMO 안전관리 우수 기관’ 과기부 장관상 수상
- [동정]서울특별시 서남병원, 2025 공공보건의료 성과보고회에서 ‘보건복지부 장관상’ 수상













