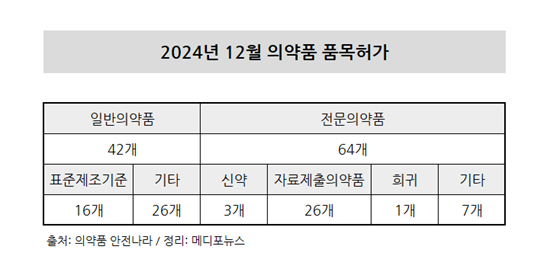
12월 허가 의약품 106개 중 전문의약품 64개
식품의약품안전처 의약품안전나라를 통해 2024년 12월 의약품 허가 현황이 확인됐다.
2024년 12월 허가된 의약품은 총 106개로 이 중 전문의약품은 약 60%에 달하는 64개로 확인됐다. 신약이 3개, 자료제출 의약품이 26개, 희귀의약품이 1개, 기타 의약품이 7개였다.
먼저 12일 국내 38번째 신약 ‘어나프라(성분명 오피란제린)’가 허가됐다.
어나프라는 성인들의 수술 후 중등도-중증 급성통증 조절을 위한 단기 요법에 사용되는 주사제로 기존 마약성 진통제 또는 NSAIDs 진통제와 다른 새로운 기전을 가진 치료제다. 글라이신 수송체 2형과 세로토닌 수용체 2A형을 저해해 진통 효과를 나타낸다.
다음으로는 한국GSK ‘아렉스비’는 60세 이상을 대상으로 RSV에 의한 하기도 질환 예방 백신으로 허가를 받았다.
아렉스비는 3상연구인 RSV OA=ADJ-006, RSV OA=ADJ-004 결과를 근거로 이뤄졌다.
RSV OA=ADJ-006 연구에서 아렉스비는 첫번째 RSV 시즌에서 위약 대비 RSV-LRTD 위험성을 82.6%, 중증 RSV-LRTD 위험성을 94.1% 유의하게 감소시켰다. RSV-A 관련 LRTD 증례 및 RSV-B 관련 LRTD 증례에 대한 백신 유효성은 각각 84.6% 및 80.9%였다. 두 번의 RSV 시즌 동안 평균 추적 기간은 17.8개월로 60세 이상의 시험대상자의 RSV-LRTD에 대한 유효성은 67.2%, 중증 RSV-LRTD에 대한 유효성은 78.8%였다.
RSV OA=ADJ-004 연구에서 아렉스비 접종 1개월 후의 RSV-A 및 RSV-B 중화항체 기하평균 역가는 백신 접종 전에 비해 각각 10.5배 및 7.8배였고, 백신 접종 6개월 후에는 각각 4.4배 및 3.5배였다.
또 마지막 날 성장판이 안 닫힌 4개월 이상 소아의 연골무형성증 치료제 ‘복스조고주0.4・0.56・ 1.2mg(보소리타이드)’도 허가됐다.
연골무형성증은 연골세포 증식 및 분화 조절 유전자인 FGFR-3 돌연변이로 인해 발생하는 골성장 관련 유전 질환이다.
복스조고는 소아 연골무형성증 환자에서 과분화된 FGFR-3 신호를 억제해 연골세포의 증식 및 분화를 유도함으로써 연골 내 뼈 형성을 촉진하는 치료제로, 기존에는 소아 연골무형성증 치료제가 없었다. 글로벌 혁신제품 신속심사 지원체계 제10호 제품으로 지정됐다는 점에서 의미를 더했다.
특히 희귀의약품으로 분류된 제품 중에서는 싸이젠코리아의 ‘테파디나(성분명 티오테파)’도 허가를 받은 것이 확인됐다.
테파디나는 전신 방사선조사의 병행 여부와 상관없이 성인, 소아 환자의 혈액학적 질환에서 동종 또는 자가 조혈모세포이식(HPCT) 이전 전처치요법 △성인 및 소아 환자의 고형암 치료를 위해 조혈모세포이식과 함께 고용량의 화학요법이 적절한 경우에 다른 화학요법과 병용해 사용할 수 있다.
일반의약품은 42개였다. 표준제조기준 의약품이 16개, 기타 의약품이 26개였다. 대웅제약의 ‘대웅글루타치온정100mg’, 동국제약 ‘판시딜액3%’, 대원제약의 ‘브이콜드시럽’, 한미약품의 ‘마그네비스피드액’, 동아제약의 ‘판텍에이액’ 등이 허가됐다.
노영희 기자 nyh2152@medifonews.com
< 저작권자 © Medifonews , 무단전재 및 재배포금지 >
- 본 기사내용의 모든 저작권은 메디포뉴스에 있습니다.
