리스티고 등 전문의약품 다수 허가
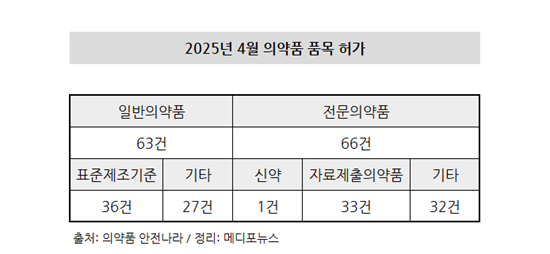
이 중 전문의약품은 66건으로 나타난 가운데, 한국유씨비제약은 ‘리스티고(성분명
로자놀릭시주맙)’에 대해 항아세틸콜린 수용체 또는 항근육 특이 티로신 키나제 항체 양성인 성인 환자의
전신 중증근무력증 치료를 위한 표준 요법에 부가요법으로 허가받았다.
리스티고는 이번 허가의 근간이 된 MycarinG 연구에서 전신 중증근무력증
환자의 증상을 신속하게 개선할 뿐만 아니라 지속적이고 장기적으로 증상을 조절한다는 점을 입증했다.
리스티고 7mg/kg 투여군은 치료
43일 차에 일차평가변수인 MG-ADL(일상생활 수행능력 평가 척도) 총점이 베이스라인 대비 3.37점 감소해, 0.78점의 감소를 보인 위약군 대비 유의미한 개선을 보였다. 이차평가변수인
근육 약화 정도를 평가하는 QMG(정량적 중증 근무력증) 점수도
위약군 보다 베이스라인 대비 더 높은 총점 감소폭을 보였다.
MycarinG 연구 추적 기간을 연장한 공개연장시험에서도, 리스티고 투여군은 지속적으로 MG-ADL, MGC, QMG 수준이
개선 및 유지됐다.
GC녹십자는 39호 국산신약이자
탄저백신인 ‘배리트락스’를 승인받으며 백신주권을 확보했다.
탄저균은 열악한 환경에서도 장기간 생존이 가능해 공기 중 살포가 용이한 1급
법정감염병으로, 치명률도 97%에 달해 테러에 생물학 무기로
악용될 가능성이 높다.
배리트락스는 2종의 탄저균 독소인자를 세포 내로 전달해 주는 방어항원
단백질을 유전자 재조합 기술을 이용해 만들어 낸 백신으로, 백신을 접종함으로써 미량의 탄저균 독소인자가
남아 부작용을 유발할 가능성이 있는 기존 백신의 한계점을 제거했다.
녹십자에 따르면 임상2상 결과 배리트락스는 탄저균 독소를 무력화시킬
수 있는 항체가 충분히 생성되는 것을 확인했고 급성 및 중증의 이상사례는 발생하지 않았다. 경미한 이상증상은
백신 접종 그룹과 위약 접종 그룹 간에 차이가 없는 것으로 나타나 백신의 유효성과 안전성을 확인했다.
특히 임상3상을 대체한 동물실험에서도 백신 4회차 접종 후 6개월이 지나도 높은 탄저 독소 중화 항체가가 유지됐고
탄저균 포자에 대해서도 높은 생존율이 확인돼 뛰어난 효과를 입증했다.
삼성바이오에피스는 골다공증 및 전립선암∙유방암 환자의 골 소실 치료에
쓰이는 프롤리아 시밀러 ‘오보덴스(성분명 데노수맙)’의 품목허가에 성공했다.
오브덴스는 앞서 지난 2월 미국과 유럽에서 각각 오스포미브(Ospomyv)와 오보덴스(Obodence)러는 이름으로 허가를 받았다. 회사측은 이번 허가로 국내 환자들의 치료 선택권도 확대될 것으로 내다보고 있다. 올해 3월 이뤄진 공동판매 협력에 따라 향후 오보덴스의 국내 마케팅과
영업에 있어 한미약품이 함께 할 예정이다.
한편 일반의약품 중에서는 코아팜의 ‘키즈노펜산’, 대웅제약의 ‘대웅카디정’, 옵투스제약의
‘칼디본플러스정’, 일양약품의 ‘조인업더블플라스타’ 등이 허가됐다.
노영희 기자 nyh2152@medifonews.com
< 저작권자 © Medifonews , 무단전재 및 재배포금지 >
- 본 기사내용의 모든 저작권은 메디포뉴스에 있습니다.
