비소세포폐암, 유방암, 요로상피암, 고형암 등 다양한 암종 치료 기대
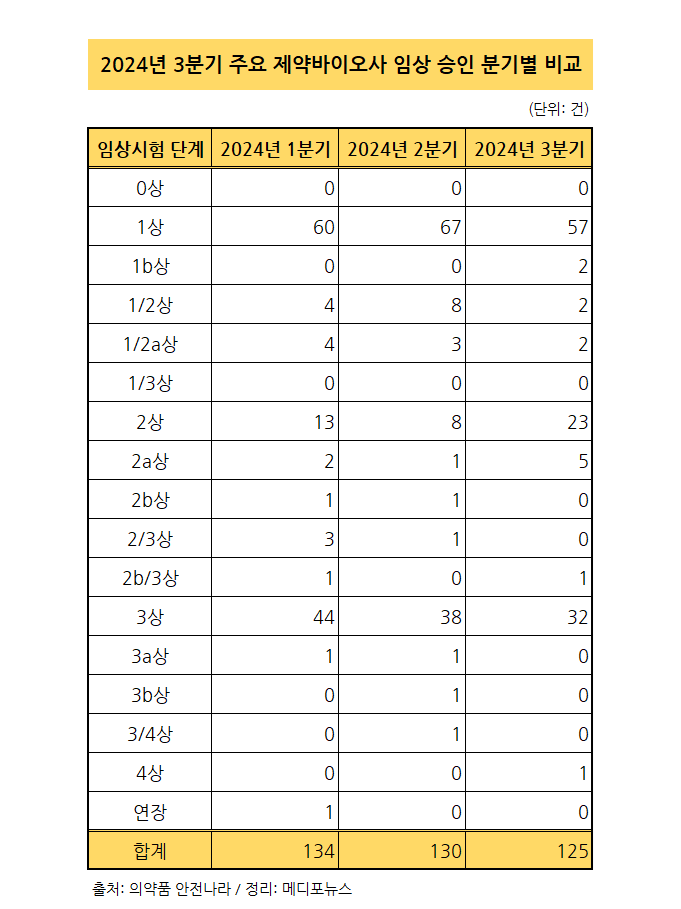
2024년 3분기 주요 제약바이오사의 임상시험 승인 현황을 확인한 결과, 약 125건의 임상시험이 승인된 것으로 나타났다. 올해 1, 2분기와 큰 차이는 없었지만 이번 3분기에는 특히 임상2상 단계 승인 건수가 전분기들 대비 많은 모습이었다.
1상이상 2상미만 단계에서는 약 63건의 임상시험이 승인됐다. 특히 이 단계에서는 보령이 5건으로 가장 많은 임상시험을 승인받았다. 승인 대상 약물은 BR5002, BR1400, BR1019, BR3409(2건)이었다.
대표적으로 BR5002는 건강한 성인 자원자를 대상으로 ‘BR5002-3’과 ‘BR5002-2’의 약동학과 안전성을 비교∙평가하기 위한 임상시험을, BR1400은 건강한 성인 자원자를 대상으로 ‘BR1400-1’, ‘BR1400-2’, ‘BR1400-3’ 투여 시의 용량별 약동학적, 약력학적 특성과 안전성을 비교∙평가하기 위한 임상시험을 승인받았다.
다국적제약사 중에서는 베이진코리아가 2건의 임상시험을 승인받았다.
임상시험을 승인받은 약물 중 BGB-43395는 전이성 HR+/HER2- 유방암 및 기타 진행성 고형종양 환자를 대상으로 단독으로 또는 병합요법의 일부로 투여되는 CDK4 억제제다. BGB-B2033은 선택된 특정 진행성 또는 전이성 고형종양 참가자를 대상으로 단독으로 또는 티슬렐리주맙과의 병용요법에 대해 연구하는 임상시험을 승인받았다.
2상이상 3상미만 단계에서는 총 29건의 임상시험이 승인받았으며, 이 중에서도 한국MSD의 임상시험 승인 건수가 4건으로 가장 많았다.
한국MSD가 승인받은 제품들 중 벨주티판_풀베스트란트에 대한 임성시험도 있는데, 이는 이전에 내분비요법을 받던 도중 질병진행을 경험한 에스트로겐 수용체 양성, HER2허투 음성의 절제 불가능한 국소 진행성 또는 전이성 유방암 참가자를 대상으로 승인됐다.
또 mRNA-4157 RNA/V940도 임상시험을 승인받았는데, 이 임상은 근치적 절제술을 받은 고위험 근육 침습성 요로상피세포암종 환자를 대상으로 V940(mRNA-4157)+펨브롤리주맙 보조요법을 위약군과 비교하는 임상시험이다.
2건의 임상시험을 승인받은 한국베링거인겔하임은 ‘BI 1810631’과 ‘BI 1819479’에 대한 임상시험을 승인받았다.
BI 1810631는 HER2 돌연변이 또는 과발현/증폭이 있는 선별된 고형암 치료에 대한 경구제의 유효성과 안전성을 평가하는 임상으로, BI 1819479는 특발성 폐섬유증 환자를 대상으로 최소 24주 동안 여러 용량에 대한 유효성, 안전성 및 내약성을 평가 임상으로 승인받았다.
3상이상 단계에선 33건의 임상시험 승인 현황이 나타났다. 임상3상 단계에서 가장 많은 임상시험을 획득한 제약사는 아스트라제네카로 약 5건의 임상시험을 승인받았다.
‘DS-8201a’는 1차선택치료 대상인 국소진행성 또는 전이성 HER2 발현 담도암에 대해 트라스투주맙 데룩스테칸+릴베고스토미그 요법을 표준치료인 젬시타빈, 시스플라틴 및 더발루맙과 비교하는 임상시험으로 허가받았다.
‘AZD2936’는 종양에 PD-L1이 발현된 전이성 편평세포 비소세포폐암 환자의 1차선택치료로서 릴베고스토미그 또는 펨브롤리주맙을 백금 기반 화학요법제와 병용투여하는 임상시험으로 승인됐다.
한국릴리는 ‘레브리키주맙’에 대한 임상시험 3건을 승인받은 것으로 나타났는데 각각 △통년성 알레르기성 비염 환자 △중등도-중증 아토피 환자 △비용종 동반한 만성 비부비동염 성인 환자를 대상으로 한 연구였다.
한국MSD 역시 3건의 임상시험을 승인받은 가운데 이 중 2건이 비소세포폐암 관련 임상이었다.
‘MK-3475A’은 PD-L1 TPS가 50% 이상인 전이성 비소세포폐암 1차치료에서 히알루론산분해효소와 함께 조성된 피하용 펨브롤리주맙을 정맥용 펨브롤리주맙과 비교하는 임상시험으로, ‘mRNA-4157 RNA/V940’은 절제가 이루어진 제II, IIIA, IIIB(N2)기 비소세포폐암 환자를 대상으로 V940(mRNA-4157)+펨브롤리주맙 보조요법을 위약군과 비교하는 임상시험으로 허가받았다.
유일하게 임상4상을 허가받은 한국오츠카제약의 델티바정 국내 퀴놀론 감수성 다제내성 폐결핵 환자 대상 9개월 MDR-END 요법(델라마니드, 리네졸리드, 레보플록사신, 피라진아미드)의 유효성 및 안전성에 대한 레지스트리 확보를 위해 승인받았다.
노영희 기자 nyh2152@medifonews.com
< 저작권자 © Medifonews , 무단전재 및 재배포금지 >
- 본 기사내용의 모든 저작권은 메디포뉴스에 있습니다.
