국가예방접종백신 7종·기타예방접종 2종 해당
“대부분 백신, 내년 상반기까지 수급 안정화 예상”
지에스케이사(GSK社)가 자체적으로 허가 관련 문서보완 등을 위해 지난 10월 26일부터 자사 백신 9종의 국내 출하를 일시 중지함에 따라 대체백신에 관한 실시기준이 마련됐다.
9종의 백신 중 7종은 국가예방접종백신으로, ▲다회접종백신 6종(인판릭스아이피브이(DTaP-IPV, 기초 3회), 인판릭스아이피브이힙(DTaP-IPV/Hib, 기초 3회), 신플로릭스(PCV10, 4회), 서바릭스(HPV2, 2회) 프리오릭스(MMR, 2회), 하브릭스(HepA, 2회))과 ▲1회 접종 백신 1종(부스트릭스(Tdap))이다. 나머지 국가예방접종사업 외 백신 2종은 로타릭스(로타바이러스 백신, 2회)와 멘비오(수막구균 백신, 최대 4회 접종)이다.

질병관리청은 18일 국가예방접종사업의 차질 없는 수행을 위해 GSK社 대체백신 실시기준을 마련해 지자체 및 의료계에 안내했다고 밝혔다.
지난 10월 28일 질병청은 신규 1차 접종 시에는 GSK社 백신을 사용하지 않고 다른 제약사 백신을 우선 접종하고, GSK社 백신 보유분은 GSK社 백신으로 접종을 시작한 경우 이후 접종에만 접종하도록 권고했다.
또한, GSK社의 동일백신으로 추가접종이 불가능한 경우를 대비해 다른 제약사의 백신으로 교차접종 가능여부를 국외 사례조사, 전문가 검토 및 예방접종전문위원회의 심의를 거쳐 확정해 실시기준을 마련했다.
이번에 공급이 중단된 GSK社 백신 중 홍역‧유행성이하선염‧풍진(MMR) 백신과 A형간염 백신은 다른 제약사 백신과 교차접종이 가능하지만, ▲디프테리아 ▲파상풍 ▲백일해(DTaP) 기초접종 ▲폐렴구균(PCV) ▲사람유두종바이러스 감염증(HPV) 백신은 원칙적으로 동일 제조사 백신으로 접종 완료하는 것을 권장하고 있다.
하지만 예방접종전문위원회는 백신공급 중단 등 불가피한 경우 접종 지연보다는 교차접종으로 접종을 완료하는 것이 이득이 크므로, GSK社 백신으로 기접종자 중 추가접종이 필요한 경우 가급적 의료기관이 보유 중인 GSK社의 동일백신을 사용하되, 동일백신이 없는 경우 다른 제약사의 대체백신으로 접종하도록 권고했다.
교차접종 가능 대체백신 9종은 다음과 같다.
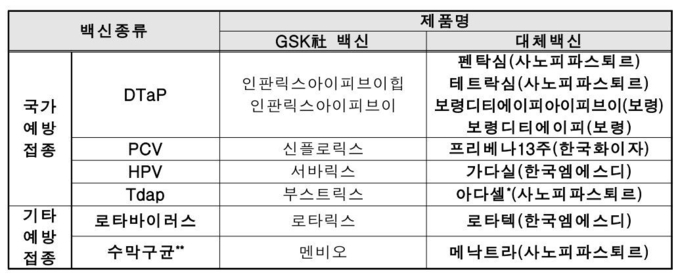
국가예방접종 백신에서 ▲(DTap) 인판릭스아이피브이힙/인판릭스아이피브이 → 펜탁심(사노피파스퇴르), 테트락심(사노피파스퇴르), 보령디티에이피아이피브이(보령), 보령디티에이피(보령) ▲(PCV) 신플로릭스 → 프리베나13주(한국화이자) ▲(HPV) 서바릭스 → 가다실(한국엠에스디) ▲(Tdap) 부스트릭스 → 아다셀(사노피파스퇴르)이다. 단, 아다셀은 임신부에서 접종 가능하지만 임신부는 국가예방접종 지원사업 대상이 아니다.
기타예방접종 백신에서는 ▲(로타바이러스) 로타릭스 → 로타텍(한국엠에스디) ▲(수막구균) 멘비오 → 메낙트라(사노피파스퇴르)이다.
질병청은 이번 GSK社의 국가예방접종백신 공급중단과 관련해 백신 제조(수입)사들과의 개별 간담회를 개최해 대부분의 백신은 내년 상반기까지 수급이 안정될 것으로 예상되지만, 단기적으로 일부 부족이 있을 수 있는 백신은 국내 수입을 조속히 조치해 줄 것을 요청했다.
또 향후 관계부처 및 백신 제조(수입)사 등과 긴밀한 정보공유 및 업무협조를 해나가겠고 밝혔다.
질병관리청 정은경 청장은 “이번에 안내된 국가예방접종 실시기준에 따라 불가피한 경우 교차접종을 실시해 접종이 적기에 완료될 수 있길 바란다”라며 “예방접종사업이 차질 없이 진행될 수 있도록 국내 백신 수급에 최선을 다하겠다”고 밝혔다.
신대현 기자 sdh3698@medifonews.com
< 저작권자 © Medifonews , 무단전재 및 재배포금지 >
- 본 기사내용의 모든 저작권은 메디포뉴스에 있습니다.
