3상 이상 단계에서는 AZ, 사노피, MSD 등 다수 허가
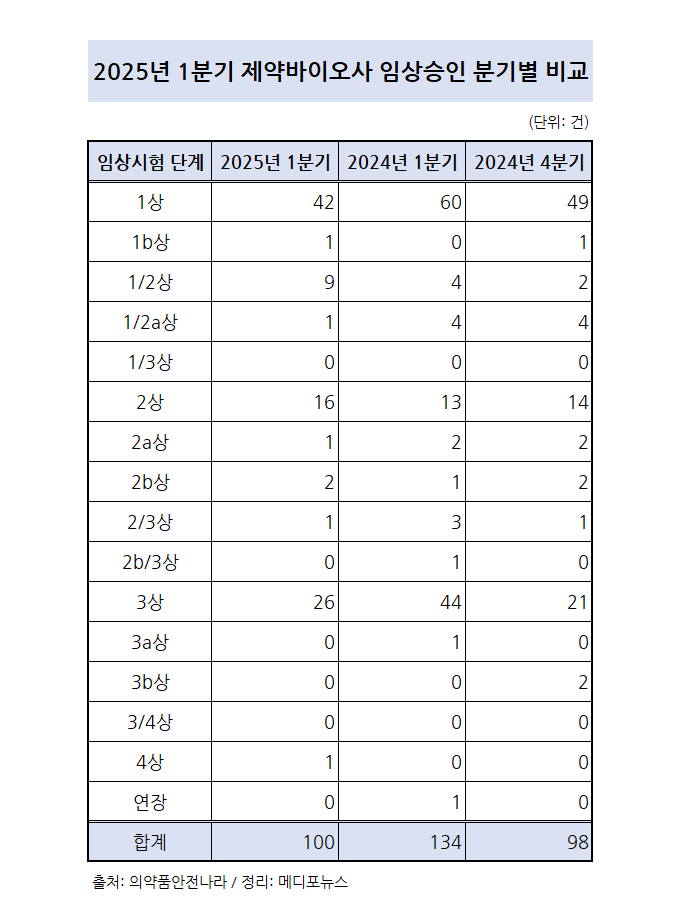
식품의약품안전처 의약품안전나라에 따르면 2025년 1분기 주요 제약바이오사는 100여건의 임상시험을 승인받은 것으로 나타났다.
세부적으로는 1상이상 2상미만이 53건, 2상이상 3상미만은 26건, 3상이상은 27건으로 확인됐다.
1상이상 2상미만 단계에서는 유한양행 자회사인 애드파마가 5건으로 가장 많았다. 내용을 살펴보면 AD-120, AD-115A, AD-227, AD-113, AD-228 등에 대한 임상시험이 승인받았다.
베이진코리아에서도 올 1분기 1상 단계에서 4건의 임상시험을 승인받았다. 대표적으로 BG-60366는 EGFR-돌연변이 비소세포 폐암 환자를 대상으로 EGFR 분해 CDAC인 BG-60366의 안전성, 내약성 등에 대해 연구하는 임상시험으로 승인받았다.
또 BGB-58067는 진행성 고형 종양 환자를 대상으로 한 MTA-협력 PRMT5 억제제 ‘BGB-58067’의 안전성 등을 조사하는 임상시험으로 승인됐다. 이외에도 BG-68501/BGB-43395, BG-C137에 대한 임상시험이 승인됐다.
2상 이상의 임상시험에서는 한국MSD가 3건을 승인받으며 가장 많이 승인받은 것으로 확인됐다.
Sotatercept /MK-7962 (ACE-011)는 표준치료를 받고 있는 폐동맥고혈압 참가자를 대상으로 체중 구간별 투여 방식을 이용해 투여되는 Sotatercept(MK-7962)의 안전성과 내약성평가를 목적으로 승인됐다.
MK-1022는 고위험 조기 병기 삼중음성 또는 호르몬 수용체 약양성/HER2 음성 유방암에서 수술 및 Pembrolizumab 보조 요법 전 환경에서 Carboplatin/Paclitaxel + Pembrolizumab 이전 또는 이후에 Patritumab Deruxtecan + Pembrolizumab을 투여하는 방식의 안전성과 유효성을 화학요법과 병합 투여하는 Pembrolizumab과 비교 평가하는 연구로 승인됐다.
MK-1167는 경도 내지 중등도 알츠하이머병 치매를 앓고 있는 참가자를 대상으로 부가 요법으로서의 MK-1167의 유효성과 안전성을 평가하기 위한 목적으로 승인됐다.
3상 이상 단계에서는 사노피-아벤티스, 아스트라제네카, MSD가 각각 4건의 임상시험을 승인받으며 가장 많은 임상시험을 승인받았다.
사노피-아벤티스가 승인받은 임상시험 중 대표적으로 ‘Belumosudil(SAR445761)’는 양측 폐 이식 후 만성 폐 동종이식편 기능장애(CLAD)가 있는 환자를 대상으로 승인받았으며, 이외에도 영유아 호흡기세포융합바이러스 및 폐렴구균, 만성 비부비동염 등에 대한 3상 임상시험이 승인됐다.
아스트라제네카가 승인받은 약제 중 ‘AZD2936’는 HER2 양성 위암 환자의 1차 선택 치료로서 Rilvegostomig+플루오로피리미딘+트라스투주맙 데룩스테칸 병용요법을 트라스투주맙+화학요법제+펨브롤리주맙 병용요법과 비교 평가하는 연구로 허가됐다.
MSD가 승인받은 3상 임상시험 3건 중 ‘MK-2870’는 두 적응증에 대해 승인을 받았다.
이 중 하나는 백금제제 감수성의 재발성 난소암 환자를 대상으로 백금제제 기반 2제 화학요법을 이용한 2차 치료 이후 Bevacizumab을 병합하거나 병합하지 않은 Sacituzumab Tirumotecan 유지 치료의 유효성과 안전성을 표준치료와 비교 평가하기 위한 임상시험이다.
노영희 기자 nyh2152@medifonews.com
< 저작권자 © Medifonews , 무단전재 및 재배포금지 >
- 본 기사내용의 모든 저작권은 메디포뉴스에 있습니다.
