9월 허가 의약품, 전문의약품 비중이 63% 이상 차지
암 치료 신약 베그젤마, 젭젤카, 엔허투 및 오미크론 백신 스파이크박스2주 등
- 노영희 기자 nyh2152@medifonews.com
- 등록 2022-10-01 05:27:42
2022년 9월 75개 의약품의 허가 현황이 확인된 가운데 이 중 일반의약품은 29품목, 전문의약품은 46품목이 허가된 것으로 나타났다. 비록 허가된 품목 수는 적지만 전문의약품의 허가 비중이 60% 이상을 보이고 있다는 점은, 그만큼 의미있는 약품들이 많다는 것을 시사하기도 한다.
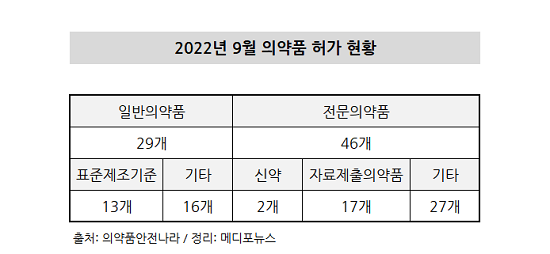
전문의약품 46개 품목 중 신약은 2품목, 자료제출의약품은 17품목, 기타 품목은 27품목이었다. 이 중 신약 2건은 셀트리온의 ‘베그젤마’와 보령의 ‘젭젤카’가 허가됐다.
셀트리온의 베그젤마(성분명 베바시주맙)은 아바스틴의 바이오시밀러로, 전이성 직결장암, 비소세포폐암, 상피성 난소암 등에 대해 허가를 받았다.
베그젤마는 국내뿐만 아니라 주요 글로벌 시장에서도 허가 소식을 알렸다. 지난 8월에는 유럽연합집행위원회(EC), 이달에는 영국 의약품규제당국(MHRA), 일본 후생노동성, 미국 식품의약국(FDA)에서 각각 허가됐다.
보령의 젭젤카(러비넥테딘)는 2020년 희귀의약품 지정 2년만에 1차 백금기반 화학요법에 실패한 전이성 소세포폐암에 대한 허가를 받았다.
소세포폐암은 비소세포폐암에 비해 전이도 잘 되고 진행 속도가 빠르며 재발률도 높은 것으로 알려졌지만 치료제 종류가 많지 않다. 그러나 소세포암은 백금계 치료가 대표적인만큼 내성을 보이거나 재발한 환자에게 새 치료옵션이 될 것으로 보인다.
또한, 젭젤카는 매 21일 간격으로 1일차 1시간만 투여받으면 되기 때문에, 다른 치료 옵션에 비해 투약 용이성도 뛰어나다는 장점이 있다.
신약 외에도 한국다이이찌산쿄의 ‘엔허투’도 허가돼 기대를 모으고 있다.
엔허투(성분명 트라스투주맙데룩스테칸)를 △이전에 두 개 이상의 항 HER2 기반의 요법을 투여 받은 절제 불가능한 또는 전이성 HER2 양성 유방암 환자의 치료 △이전에 항 HER2 치료를 포함하여 두 개 이상의 요법을 투여 받은 국소 진행성 또는 전이성 HER2 양성 위 또는 위식도접합부 선암종의 치료에 대해 허가받았다.
엔허투는 DESTINY-Breast01 임상에서 1차평가변수인 확정 객관적 반응률이 60.9%(95% CI, 53.4-68.0), 2차 평가 변수 중 일부인 반응기간 중앙값 및 무진행생존기간 중앙값이 각각 14.8개월(95% CI, 13.8-16.9)과 16.4개월(95% CI, 12.7-NR)이었다.
DESTINY-Gastric01 임상에서는 엔허투 군과 대조군 군의 비교 결과 객관적 반응률이 각각 48.4%와 12.9%(p<0.0001), 전체생존기간 중앙값은 각각 12.5개월과 8.4개월(HR : 0.59, 95% CI, 0.39-0.88, p=0.01), 무진행생존기간 중앙값(mPFS)은 각각 5.6개월과 3.5개월(HR : 0.47, 95% CI, 0.31-0.71)로 통계적, 임상적으로 유의한 개선을 나타냈다.
뿐만 아니라 코로나19와 관련해 오미크론 대응 백신도 국내에 허가됐다. 모더나의 ‘스파이크박스2주’가 그 주인공이다.
‘스파이크박스 2주(알라소메란, 이멜라소메란)’은 오미크론 함유 2가 백신으로 BA.1를 표적하는 백신으로 기존 모더나의 코로나19 백신인 스파이크박스25µg과 오미크론 변이(BA.1)를 표적으로 하는 백신 후보 물질 25µg을 결합한 차세대 2가 백신이다.
허가의 기반이 된 2/3상 임상데이터에 의하면 스파이크박스2주는 코로나19 감염 경험이 없는 참가자들을 대상으로 스파이크박스 주 50μg 추가접종의 효능과 비교 시, 오미크론(BA.1)에 대응하는 중화항체반응을 포함한 모든 주요 평가 변수를 충족했다.
임상시험 결과 스파이크박스2주 추가접종은 SARS-COV-2 과거 감염력이 없는 참가자 그룹에서 오미크론 대항 중화항체를 약 8배 증가시켰다. 또한, 기존의 스파이크박스 주와 비교 시, 새롭게 승인된 스파이크박스 2주는 오미크론 하위 변이체 BA.4와 BA.5에 대해 더욱 강력한 중화항체반응을 이끌어냈다.
접종 이전과 접종 이후 BA.4, BA.5 변이에 대한 기하 평균 배수 증가는, 스파이크박스 2주가 접종 이전에 비해 항체가 6.3배(95% CI: 5.7, 6.9), 스파이크박스 주가 3.5배(95% CI: 3.2, 3.9) 증가했다. 65세 이상 참가자를 포함한 하위 그룹 전반에 걸쳐 일관되게 나타났다.
스파이크박스 2주의 내약성은 일반적으로 우수한 것으로 나타났으며, 부작용은 기존의 스파이크박스 주와 유사한 수준이다.
일반의약품 중에서는 표준제조기준으로 13개, 기타 16개 품목이 허가를 받았다.
표준제조기준에서는 미래제약 ‘마그스타정’, 경남제약 ‘콘디에스정’, 한솔신약 ‘콜드바로정’, 한국신텍스 ‘듀오그린큐’ 등이 허가받았으며 기타 품목으로는 수출용으로 허가받은 한국코러스의 ‘코러스트리메부틴정100mg’ 등이 허가를 받았다.
관련기사
- 4월 허가 의약품 135건…전문의약품 66% 2024-04-03
- 2월 91개 의약품 허가…전문의약품 비중 59% 2024-03-04
- 1월 허가의약품, 일반약이 전문약 앞질러…총 86건 허가 2024-02-05
- 12월 총 64개 의약품 허가…59.3%는 전문의약품 2024-01-06
- 11월 조현병‧폐암 치료제 등 전문약 허가 비중 50% 2023-12-04
- 10월 의약품 품목허가 70건…적응증 다양화 2023-11-02
- 9월 품목허가 131건 중 전문의약품이 70% 2023-10-05
- 8월 허가 의약품, 전문의약품 74% 이상 차지 2023-09-04
- 7월 품목허가 저조…전문의약품 비중 30% 2023-08-01
- 5월 의약품 품목허가, 전문의약품 비중 69.3% 2023-06-02
- 4월 품목허가 건수, 일반의약품이 전문의약품 앞질러 2023-05-02
- 3월 허가된 의약품은 총 128건…전문의약품 68.7% 2023-04-05
- 2월 허가된 전문의약품 76개…전체의 75%↑ 2023-03-03
- 2023년 첫 달 허가 품목은 총 249개…전문약 86% 2023-02-06
- 12월 전문의약품 허가 비중은 전체 중 73%…103개 허가 2023-01-06
- 11월 허가된 의약품 112개 중 60%는 전문의약품 2022-12-03
- 10월 허가 의약품, 최저 수량에도 알짜배기 제품 다수 2022-11-01
- 8월 의약품 품목허가 57건에 그쳐…전문약 30개 2022-09-01
- 7월 허가 의약품 119 품목 中 전문약은 88 품목 2022-08-08
- 6월 허가된 제품 97건 중 전문의약품은 74건 2022-07-04
- 5월 허가 의약품 총 190개…전문약은 157개 2022-06-04
- 4월 의약품 235개 허가…당뇨약 다수 2022-05-02
- 3월 의약품 허가 98개 허가…전문약 62개 2022-04-02
- 2월 의약품 108품목 허가…전문약 69개 2022-03-04
- 임인년 첫 달, 의약품 198개 품목허가 2022-02-04
- 식약청, 전문약 61개 등 품목허가 현황 발표 2010-01-22
- 식약청, ‘조페닐정’ 등 240품목 주간 허가 2010-01-08
- 식약청, '씨랜스정' 주간 의약품 품목취하 2009-12-18
- 주간 품목허가 현황, 스트라테라캡슐 등 총 53품목 2009-12-04
- 식약청, 지난주 품목허가(신고) 현황 총 23품목 2009-11-28
- 신종플루백신 등 주간의약품 56품목 허가 2009-10-30
- 녹십자 인플루엔자백신 등 허가 2009-07-31
- 개량신약인정 채택후 ‘아모잘탄정’ 등 첫 허가 2009-04-11
- ‘유리토스정’-‘두창백신’ 신약 등 신규 허가 2009-01-12
- [동정]칠곡경북대병원 성인 수두증 클리닉, 30억원 치매극복 기술개발 과제 수주
- [부음]장명섭 포천시약사회장 빙모상
- [인사]건일제약, 오인수 신임 마케팅본부장 영입
- [화촉]조계남 하나제약 이사 장남 (6/9)
- [화촉]박근영 백제약품 동부지점 수석부사장 장녀 (5/11)
- [화촉]최동재 前 하나제약 대표 차남 (5/11)
- [인사]삼천당제약 2024년 정기승진인사 (4/23)
- [부음]조대진 일양약품 중앙연구소 상무 빙모상
- [인사]오태윤 강북삼성병원 교수, 의료기관평가인증원 제6대 원장 임명
- [동정]한국머크 바이오파마, ‘일∙가정 양립 우수 기업’ 선정
- [동정]칠곡경북대병원 성인 수두증 클리닉, 30억원 치매극복 기술개발 과제 수주
- [동정]한국머크 바이오파마, ‘일∙가정 양립 우수 기업’ 선정
- [동정]고대 구로병원 송준영 교수, 질병청·국립보건연구원 학술연구용역 과제 선정
- [동정]일동후디스 하이뮨, 브랜드파워 단백질보충제 부문 2년 연속 1위
- [동정]서울성모병원 정미향 교수, 국제학술지 유럽예방심장학회지 부편집장 임명
- [동정]한올바이오파마, 국가산업대상 ‘연구개발’ 부문 수상
- [동정]제주대병원 연구팀, 국제학술지에 심장재활 논문 게재
- [동정]동화약품, 박진 신임 공장장 취임
- [동정]칠곡경북대병원 남수연 교수팀, 국제학술지에 콜레스테롤과 소화기암 상관관계 논문 게재
- [동정]서울시醫, 제57회 유한의학상 대상에 연세의대 신경과학교실 남효석 교수 선정















