약물이상반응 위험에 노출된 의약품 시험대상자…식약처는 방관
임상시험의 약물이상반응 발생 가능성 정보 제공해야
- 김경애 기자 seok@medifonews.com
- 등록 2018-10-18 05:50:00
약물이상반응이 해마다 증가하는 가운데, 의약품 임상시험에 참여하는 시험대상자 권리보호 · 구제를 위한 체계는 미비한 실정이다.
 국회 보건복지위원회 소속 정춘숙 의원(더불어민주당)이 17일 식품의약품안전처(이하 식약처)로부터 제출받은 2015년부터 2017년까지 의약품 임상시험 · 생동성시험 · 약물이상반응 신고건수에 따르면, 3년간 임상시험 · 생동성시험 승인건수는 900건 · 813건 · 833건으로 감소세를 보이나 의약품 임상시험 중 발생한 약물이상반응 신고건수는 △2015년 238건 △2016년 309건 △2017년 290건으로 오히려 증가한 것으로 나타났다. 승인 건수 대비 부작용 신고 건수가 차지하는 비율은 2016년에는 38%에 달했다.
국회 보건복지위원회 소속 정춘숙 의원(더불어민주당)이 17일 식품의약품안전처(이하 식약처)로부터 제출받은 2015년부터 2017년까지 의약품 임상시험 · 생동성시험 · 약물이상반응 신고건수에 따르면, 3년간 임상시험 · 생동성시험 승인건수는 900건 · 813건 · 833건으로 감소세를 보이나 의약품 임상시험 중 발생한 약물이상반응 신고건수는 △2015년 238건 △2016년 309건 △2017년 290건으로 오히려 증가한 것으로 나타났다. 승인 건수 대비 부작용 신고 건수가 차지하는 비율은 2016년에는 38%에 달했다. 정 의원은 "임상시험 참여자들은 해당 시험에 어떤 위험성이 있는지 잘 인지하지 못하는 경우가 많다. 이를 미연에 방지할 수 있는 장치를 식약처 차원에서 마련했으면 한다."라고 했다.
 건강세상네트워크(이하 건세)는 17일 보도자료를 통해 식약처가 임상시험에 참여하는 시험대상자 권리를 보호할 의무 · 책임이 있다며, 시험대상자 권리보호 · 구제를 위한 체계를 마련할 것을 주문했다.
건강세상네트워크(이하 건세)는 17일 보도자료를 통해 식약처가 임상시험에 참여하는 시험대상자 권리를 보호할 의무 · 책임이 있다며, 시험대상자 권리보호 · 구제를 위한 체계를 마련할 것을 주문했다.금년 10월부터 임상시험 대상자에게 예상 가능한 부작용 정보를 제공할 것을 의무화하는 내용이 규정됐지만, 예상하지 못한 약물이상반응에 대한 고지의무는 대상에 포함하지 않았다.
'의약품 임상시험 관리기준'에 의하면, 약물이상반응은 임상시험용의약품의 임의 용량에서 발생한 모든 유해하고 의도하지 않은 반응으로, 임상시험용 의약품과의 인과관계를 부정할 수 없는 경우이다. 이에 식약처는 임상시험 중 발생한 '예상하지 못하고 중대한' 약물이상반응(SUSAR)을 관리하고 있다.
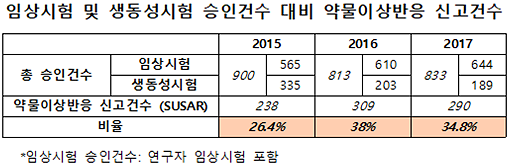
건세는 "식약처가 이번에 제출한 SUSAR은 중대하고 예상치 못한 약물이상반응 현황이기 때문에 경미한 약물이상반응이 미포함됐을 수 있다. 이를 고려하면 임상시험 중 발생한 약물이상반응은 위 표의 건수보다 많을 것이다. 전체 임상시험 10건 중 최소 3~4건 이상에서 약물이상반응이 나타나고 있으므로 그 빈도가 높다고 할 수 있다."라고 언급했다.
식약처는 약물이상반응을 임상시험 의뢰자로 하여금 보고하도록 규정해 그 현황을 SUSAR로 관리한다. SUSAR은 임상시험에 참여하고자 하는 사람들에게는 참여할지 말지를 선택할 수 있는 중요한 판단 근거가 되는 유용한 자료임에도 식약처는 약물이상반응에 대한 내용을 공개 자료로 발표하고 있지 않다.
건세는 "SUSAR 현황은 임상시험 대상자는 물론 모든 국민이 알 수 있게 투명하게 공개해야만 하는 정보이다. 시험대상자들은 임상시험 중에 예상치 못한 약물이상반응이 발생할 수 있다는 사실에 대해 설명서 · 동의서 방식으로 정보를 제공받을 권리가 있다."라면서, "약물이상반응이 시험대상자 건강에 미치는 중대함을 고려할 때 식약처의 약물이상반응 관리 체계에 대한 검토를 해야 한다."라고 주장했다.
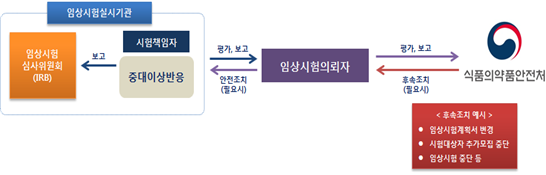
'의약품 임상시험 관리기준'에 의하면, 임상시험 중 약물이상반응 발생 시 임상시험 실시기관은 임상시험 의뢰자에게 발생현황에 대해 보고해야 하고, 임상시험 의뢰자는 식약처가 정한 서식에 맞게 보고하도록 규정하고 있다. 즉, 보고책임 주체가 임상시험 의뢰자임을 명확히 하고 있다.
임상시험 의뢰자는 임상시험 과정에서 시험대상자에게 발생한 부작용 · 이상반응을 의약품과의 인과관계 여부와 상관없이 모두 보고해야 한다. 그런데 '약물이상반응 보고서식'을 보면 식약처는 인과관계 관련성에 대한 평가 책임을 임상시험책임자 · 의뢰자에게 부과하고 있다(아래 별첨 '약물이상반응 보고서식').
건세는 "중대한 약물이상반응 · 사망사례에서 시험대상자에 대한 보상기준 · 금액을 정함에 있어 의약품과의 관련성 평가는 중요한 판단 근거가 될 수 있다. 그러므로 이해관계가 있는 임상시험 실시기관 · 임상시험 의뢰자가 의약품과의 관련성을 평가하는 것은 비적절하다. 최소한 임상시험 실시기관 · 의뢰자가 일차적으로 관련성 평가를 수행한다고 할지라도 이러한 평가가 적절하게 수행됐는지, 평가가 타당한지 등에 대한 객관적 · 다각적 검증 및 모니터링을 해야 할 필요가 있다. 시험대상자들은 약물이상반응 · 의약품 간 관련성에 대한 정보를 제공받아야 한다."라고 설명했다.
이어서 "식약처가 제출한 '임상시험 약물이상반응 관리체계' 자료를 살펴보면, 식약처는 임상시험 의뢰자가 보고한 임상시험 실시기관의 관련성 평가내용을 포함한 의약품과의 관련성 평가에 대해 검토만 할 뿐, 내부 보고된 의약품과의 관련성 평가 검증 업무를 수행하지는 않는 듯하다."라고 했다.
국민 안전 · 건강에 영향을 직접 미치는 식품 · 의약품의 안전에 관해 사무를 관장하는 국가기관인 식약처에 대해 의약품 안전이라는 전문 영역에서 신뢰성 확립이 중요하다고 했다.
건세는 "신뢰성 확립을 위해 식약처는 약물이상반응 사례에 대한 보고자들의 의약품 관련성 평가에 대한 검증 · 모니터링 절차를 마련해야 하며, 임상시험계획 승인 권한을 가진 정부 기관으로 임상시험에 참여하는 시험대상자 권리를 보호할 의무 · 책임이 있다."라면서, "식약처는 관련 규정 개정을 통해 임상시험 대상자에게 임상시험 과정에서 예상하지 못하는 약물이상반응 발생 가능성에 대한 정보를 제공하고, 약물이상반응 발생 시 의약품과의 관련성 평가 결과에 대해서도 시험대상자에게 고지하게 하는 규정을 마련해야 한다."라고 주장했다.
참고자료
- 약물이상반응 보고서식.pdf / 자료 제공: 건강세상네트워크
- [인사]사노피 배경은 대표, 한국 및 호주/뉴질랜드 제약 총괄 다국가 리드 선임
- [인사]연세대학교의료원 인사
- [인사]서울성모병원 오득영 교수, 대한미용성형외과학회 이사장 취임
- [인사]고대 안암병원 함병주 교수, 대한생물정신의학회 이사장 취임
- [인사]솔바이오, 반경식 신임대표 선임
- [인사]한국원자력의학원 인사(4/15)
- [인사]대구가톨릭대병원 박준수 교수, SCOPUS 등재 저널 편집장 위촉
- [인사]차원태 박사, 차 의과학대학교 제13대 총장에 선임
- [인사]서울대 백롱민 교수, 국가 통합 바이오 빅데이터 구축 사업단장 선정
- [인사]홍창권 前 중앙의료원장, 국가생명윤리정책원 원장에 임명(4/8)
- [동정]제주대병원 연구팀, 국제학술지에 심장재활 논문 게재
- [동정]동화약품, 박진 신임 공장장 취임
- [동정]칠곡경북대병원 남수연 교수팀, 국제학술지에 콜레스테롤과 소화기암 상관관계 논문 게재
- [동정]서울시醫, 제57회 유한의학상 대상에 연세의대 신경과학교실 남효석 교수 선정
- [동정]고대의대 김은하 교수팀, ‘네이처 이뮤놀로지’에 논문 게재
- [동정]원주세브란스기독병원 이솔암 교수, 국제학술지에 백반증 연구 논문 게재
- [동정]메디컬AI, 심부전 진단 보조 AI로 IR52 장영실상 수상
- [동정]동아제약, ‘오쏘몰’ 멀티비타민 부문 국내 판매 1위 등극
- [동정]HK이노엔, ‘케이캡’ IR52 장영실상 최우수상 수상
- [동정]한미약품-여자의사회, ‘젊은의학자학술상’에 정선재 부교수 선정














